El aumento observado en los casos de diabetes gestacional y las complicaciones asociadas con esta enfermedad, tanto para la madre como para el bebé, han puesto de manifiesto la necesidad de identificar de forma precoz este tipo de diabetes para poder realizar intervenciones tempranas que limiten sus efectos secundarios. La identificación de los factores genéticos implicados en el desarrollo de la diabetes gestacional nos permitirá, no solo una detección más rápida de esta enfermedad, sino también la posibilidad de realizar tratamientos personalizados con las ventajas terapéuticas que este tipo de medicina conlleva.
La diabetes mellitus gestacional (DMG) es un tipo de diabetes que se desarrolla durante el segundo-tercer trimestre del embarazo en mujeres sín diabetes antes del embarazo, y que normalmente desaparece tras el parto [1]. Los casos identificados de DMG han aumentado considerablemente en las últimas décadas, aunque estimar la prevalencia actual para esta enfermedad no resulta una tarea sencilla, debido principalmente a que no existe un consenso a nivel internacional respecto a los programas de detección y los criterios de diagnóstico [2]. Esto ha hecho que la horquilla de la prevalencia de la DMG sea muy amplia, afectando desde un 4% a más de un 30% de los embarazos.
Entre los casos de diabetes durante el embarazo hay que diferenciar la DMG de una diabetes pregestacional no diagnosticada, que generalmente se trata de una diabetes tipo 2 (DT2) o de una diabetes monogénica (MODY), que pueden permanecer asintomáticas hasta que una situación de estrés metabólico, como es el embarazo, desencadena un fallo en la regulación de la glucosa. En estos casos, la hiperglucemia se suele manifestar en estadios más tempranos del embarazo, incluso desde el primer trimestre.
Aunque el tipo de diabetes más común durante el embarazo es la DMG, el aumento de la prevalencia de la DT2 en las últimas décadas junto con su debut más temprano, causado sobre todo por el aumento de la obesidad, ha elevado el número de mujeres en edad fértil con DT2 no diagnosticada o prediabetes que pueden desarrollar diabetes en respuesta al aumento de la demanda de insulina que ocurre durante el embarazo [3]. En ambos casos, DMG y diabetes pregestacional, es muy importante detectar esta enfermedad de forma temprana para poder tratarla, ya que una diabetes no controlada durante la gestación tiene efectos perjudiciales tanto para la madre como para el bebé. Diferentes estudios poblacionales han observado un aumento de los casos de preeclampsia y mayor incidencia de cesáreas en mujeres embarazadas con DMG, así como un aumento de la obesidad y los casos de DT2, entre otras afecciones, en los niños cuyo desarrollo fetal se dio en condiciones diabéticas no controladas. Se ha propuesto que el aumento del riesgo de diabetes entre estos niños se debe, en gran medida, a modificaciones epigenéticas causadas por un ambiente hiperglucémico durante el desarrollo fetal. Si analizamos estos efectos secundarios de la DMG nos damos cuenta que puede dar lugar a un círculo vicioso en el que una DMG no controlada aumenta el riesgo de DT2 en la progenie, lo que causa un aumento del número de mujeres en edad fértil con DT2 y por lo tanto los casos de diabetes durante el embarazo. Es por ello muy importante, tanto para la salud de la madre como la del bebé, la realización de pruebas de cribado durante el embarazo para detectar estos casos de diabetes.
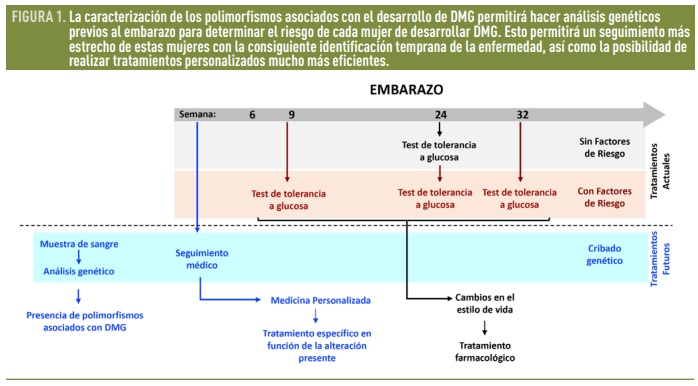
La prueba de cribado más aceptada es la prueba de la tolerancia a la glucosa, que se suele realizar entre las semanas 24 y 28 del embarazo, si bien en el caso de que existan factores de riesgo como antecedentes familiares de diabetes u obesidad, esta prueba puede ser realizada en la primera consulta, y repetida a las 24-28 semanas y a las 32-36 semanas en caso de que las primeras pruebas diesen negativas. Ante un resultado positivo de DMG, cambios en el estilo de vida, con una dieta adecuada y específica para estas situaciones junto con la realización de un ejercicio moderado suele ser suficiente para mantener un adecuado control de la glucemia, aunque en algunos casos puede ser necesaria la administración de insulina u otros medicamentos [2].
Una detección precoz de la diabetes durante el embarazo permitirá una intervención temprana asegurando la normoglucemia materna y el desarrollo fetal adecuado.
¿Por qué el embarazo es un detonante en el desarrollo de diabetes?
Durante el embarazo, el metabolismo de la madre se ve modificado para potenciar el crecimiento del feto. Activado por hormonas placentarias, la madre desarrolla una progresiva resistencia a la insulina, que hace que los tejidos maternos requieran mayores niveles de insulina para usar la glucosa, favoreciendo de esta forma el paso de la glucosa al feto, y asegurar así su correcto crecimiento. En respuesta a esta mayor demanda de insulina se activa una respuesta adaptativa en el páncreas materno que conlleva el aumento de la masa de células beta pancreáticas productoras de insulina y un aumento de la secreción de insulina. Estos mecanismos aseguran una producción de insulina suficiente para mantener la normoglucemia de la madre [4]. Sin embargo, hay situaciones en las que estos procesos adaptativos no son suficientes para compensar el aumento en la demanda de insulina, produciéndose una hiperglucemia y el desarrollo de DMG.
Dos de los factores de riesgo más importantes para el desarrollo de DMG son la existencia de sobrepeso/obesidad antes del embarazo y una edad más avanzada durante de la gestación. La obesidad generalmente cursa con un aumento de la resistencia a insulina que activa la respuesta adaptativa de las células beta para compensar el incremento en la demanda de insulina. En estos casos, el estrés metabólico derivado del embarazo aumenta aún más esta demanda de insulina haciendo que los mecanismos de adaptación sean insuficientes para mantener el control de la glucosa, desarrollándose una DMG. El aumento de la obesidad en la sociedad actual, junto con el hecho de que los embarazos se dan a una edad más tardía, en la que los mecanismos de adaptación de los islotes pancreáticos son menos eficientes, son responsables, en gran medida, del aumento de la DMG observado en las últimas décadas. Sin embargo, aunque la obesidad claramente aumenta la incidencia de DMG, no todas las mujeres que desarrollan DMG son obesas, lo que nos indica la implicación de otros factores, como son las alteraciones genéticas que causan deficiencias en los procesos de adaptación de las células beta.
Caracterizar estos factores genéticos reviste una gran importancia ya que nos permitiría realizar pruebas de cribado para identificar aquellas mujeres con un mayor riesgo de desarrollar DMG, incluso antes de estar embarazadas. De esta forma, se podría realizar un seguimiento más estrecho de estas mujeres durante el embarazo, permitiendo un tratamiento temprano.
Factores genéticos implicados en el desarrollo de DMG
Es importante remarcar que la DMG y la DT2 tienen una patología similar, caracterizada por el aumento de la resistencia a insulina y consiguiente aumento en la demanda de insulina, acompañado de una secreción de esta hormona insuficiente para compensar este aumento de la demanda. Además de estas similitudes en la patología de la DMG y la DT2, se ha observado que las mujeres que desarrollan DMG presentan un mayor riesgo de DT2 posteriormente, sugiriéndose que el desarrollo de DMG desenmascara una predisposición metabólica a desarrollar DT2.
Por otro lado, se ha observado que tener antecedentes familiares de DT2 aumenta el riesgo de desarrollar DMG. Esta relación entre DMG y DT2 junto con el componente hereditario presente en ambas enfermedades ha sugerido la existencia de factores genéticos comunes en el desarrollo de ambos tipos de diabetes. De hecho, muchas de las variaciones genéticas (también denominadas polimorfismos) y mutaciones asociadas con el desarrollo de DT2 se han visto implicadas en el desarrollo de DMG [5,6].
En nuestro grupo hemos estudiado varios de estos genes cuyos polimorfismos/mutaciones aumentan el riesgo de desarrollar diabetes. Hemos observado que HMG20A [7], un factor cuyas alteraciones genéticas han sido asociadas tanto con DT2 como con DMG, y PAX4 [8], uno de los genes cuyas mutaciones pueden causar MODY así como otros tipos de diabetes, aumentan su expresión en el islote durante la gestación, estimulando los mecanismos de adaptación de los islotes para compensar el incremento en la demanda de insulina. Sin embargo, hay que indicar que no todos los factores genéticos asociados con DT2 se han encontrado también asociados con DMG. Esto puede ser debido a 2 causas principales: 1) la existencia de mecanismos diferentes en el desarrollo de ambos tipos de diabetes o 2) el hecho de que los estudios poblacionales en DMG incluyen un menor número de participantes en el estudio, lo que limita la identificación de estos factores. También hemos observado que hay factores, como PAX8, que solo aumenta su expresión en el islote durante el embarazo, y cuyas mutaciones hemos asociado con un mayor riesgo de desarrollar DMG [9]. Estos datos revelan el complejo carácter de DMG en cuyo desarrollo pueden intervenir factores específicos de este tipo de diabetes, junto con factores comunes a otros tipos de diabetes, lo que complica la identificación de las alteraciones genéticas responsables del desarrollo de DMG.
Además, la DMG tiene un carácter poligénico, es decir, que en muchos casos hace falta la presencia conjunta de varias alteraciones genéticas para que se desarrolle la enfermedad. Dificultando aún más la identificación de estos factores genéticos, el desarrollo de estos tipos de diabetes, depende de no solo de la presencia conjunta de varias de estas alteraciones genéticas sino también de su interacción con factores ambientales. La existencia de mutaciones/polimorfismos que afectan, principalmente, a la funcionalidad y capacidad de compensación de las células beta pancreáticas resultan en una peor adaptación de los islotes pancreáticos frente a un aumento en la demanda de insulina, como puede ser el embarazo. Estas alteraciones pueden tener diferentes grados de severidad pudiendo haber islotes que mantienenr un cierto grado de adaptabilidad. Sin embargo, si a estos islotes les imponemos un estrés ambiental adicional, como puede ser la obesidad, ya no serían capaces de adaptarse, y se desarrollaría una hiperglucemia y diabetes.
Es decir, que la presencia de estas alteraciones genéticas que favorecen el desarrollo de DMG sólo se manifiestan ante una determinada situación de estrés que causa un aumento en la demanda de insulina, por encima de la capacidad de adaptación de las células beta pancreáticas. Dos mujeres con las mismas variantes genéticas pueden responder de forma diferente al aumento de la demanda de insulina dependiendo de la presencia o no de factores ambientales como puede ser la obesidad.
Debido a las características de la DMG, la etiología y los mecanismos subyacentes a esta enfermedad han resultado evasivos, obstaculizando el desarrollo de herramientas de diagnóstico exactas. Hoy en día, gracias a los adelantos tecnológicos en secuenciación masiva y análisis globales de transcriptómica, proteómica y metabolómica, los estudios para identificar estas variantes genéticas y las alteraciones funcionales causadas por estos polimorfismos se han visto acelerados considerablemente. Aunque todavía son necesarios más estudios, estas líneas de investigación permitirán en un futuro poder, no solo identificar de forma temprana el riesgo de desarrollar DMG, sino también determinar el tratamiento más adecuado en cada caso. Ya que identificando los factores genéticos causantes de la DMG se puede identificar el defecto concreto y esto permitirá un tratamiento personalizado mucho más eficiente.
Referencias
1. American Diabetes, A. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2020. Diabetes Care 2020, 43, S14-S31.
2. Johns, E.C.; Denison, F.C.; Norman, J.E.; Reynolds, R.M. Gestational Diabetes Mellitus: Mechanisms, Treatment, and Complications. Trends Endocrinol Metab 2018, 29, 743-754.
3. Lorenzo, P.I.; Martin-Montalvo, A.; Cobo Vuilleumier, N.; Gauthier, B.R. Molecular Modelling of Islet beta-Cell Adaptation to Inflammation in Pregnancy and Gestational Diabetes Mellitus. Int J Mol Sci 2019, 20, 6171.
4. Banerjee, R.R. Piecing together the puzzle of pancreatic islet adaptation in pregnancy. Ann N Y Acad Sci 2018, 1411, 120-139.
5. Powe, C.E.; Kwak, S.H. Genetic Studies of Gestational Diabetes and Glucose Metabolism in Pregnancy. Curr Diab Rep 2020, 20, 69.
6. Dalfra, M.G.; Burlina, S.; Del Vescovo, G.G.; Lapolla, A. Genetics and Epigenetics: New Insight on Gestational Diabetes Mellitus. Front Endocrinol (Lausanne) 2020, 11, 602477.
7. Mellado-Gil, J.M.; Fuente-Martin, E.; Lorenzo, P.I.; Cobo-Vuilleumier, N.; Lopez-Noriega, L.; Martin-Montalvo, A.; Gomez, I.G.H.; Ceballos-Chavez, M.; Gomez-Jaramillo, L.; Campos-Caro, A.; et al. The type 2 diabetes-associated HMG20A gene is mandatory for islet beta cell functional maturity. Cell Death Dis 2018, 9, 279.
8. Lorenzo, P.I.; Fuente-Martin, E.; Brun, T.; Cobo-Vuilleumier, N.; Jimenez-Moreno, C.M.; I, G.H.G.; Lopez Noriega, L.; Mellado-Gil, J.M.; Martin-Montalvo, A.; Soria, B.; et al. PAX4 Defines an Expandable beta-Cell Subpopulation in the Adult Pancreatic Islet. Scientific reports 2015, 5, 15672.
9. Martin-Montalvo, A.; Lopez-Noriega, L.; Jimenez-Moreno, C.; Herranz, A.; Lorenzo, P.I.; Cobo-Vuilleumier, N.; Tamayo, A.; Gonzalez-Guerrero, C.; et al. Transient PAX8 Expression in Islets During Pregnancy Correlates With beta-Cell Survival, Revealing a Novel Candidate Gene in Gestational Diabetes Mellitus. Diabetes 2019, 68, 109-118,.