La diabetes tipo 2 (DM2) es una enfermedad heterogénea e íntimamente asociada a la epidemia de obesidad.
¿Por qué desarrollamos diabetes? Para entender la patogenia de la diabetes nos hemos esforzado en las últimas décadas en comprender el fenómeno de la resistencia insulínica y la respuesta de las células β-pancreáticas frente a ella.
En el contexto de obesidad, la capacidad funcional del tejido adiposo blanco se ve alterada provocando que la acumulación de distintos lípidos tóxicos (ceramida, diacilglicerol) y el aumento de citocinas inflamatorias impida la correcta señalización de la insulina en los tejidos, un fenómeno conocido como resistencia a la insulina, que en última instancia causa un aumento de glucosa en sangre (hiperglucemia). Presumiblemente, las células β-pancreáticas perciben la necesidad de secretar más insulina para evitar la hiperglucemia cuando existe resistencia a la insulina. La idea predominante es que el aumento de la insulina plasmática es una respuesta compensatoria a la resistencia insulínica asociada a la obesidad que resulta en el mantenimiento de los niveles de glucosa dentro de los límites prediabéticos. Cuando este estado compensatorio fracasa por el agotamiento funcional de las células β-pancreáticas, se produce una insuficiencia de insulina, responsable de la hiperglucemia que marca el debut de la DM2 [1].
No obstante, investigaciones recientes han puesto de manifiesto que no solo la secreción pancreática de insulina, y su capacidad de acción en sus tejidos diana son relevantes en la patogenia de la diabetes. También, el aclaramiento y degradación de la insulina, un aspecto poco conocido y estudiado, que regula los niveles circulantes de la hormona en sangre, podría ser clave en la patogenia de la enfermedad.
Pero ¿qué es el aclaramiento de la insulina?
Aclaramiento de la insulina
La visión clásica es que la producción y secreción de insulina por las células β-pancreáticas son los principales mecanismos de regulación de los niveles circulantes de insulina. Sin embargo, el hígado es el primer órgano que se encuentra la insulina en su viaje hacia los tejidos periféricos debido a que la hormona es secretada directamente a la vena porta. En consecuencia, el hígado está expuesto de forma única a concentraciones de insulina que pueden ser hasta 10 veces la concentración de la hormona en la circulación arterial. El mantenimiento de este gradiente portal-sistémico está mediado por una degradación sustancial de la insulina por parte del hígado, mediante un proceso denominando “aclaramiento de la insulina”, que fue observado por primera vez en 1985 por Stevenson y colaboradores [2].
En condiciones normales, más del 50% de la insulina secretada por el páncreas es eliminada al llegar al hígado, antes de abandonarlo por la vena hepática e ingresar en la circulación sistémica. En un segundo pase de la insulina por el hígado, a través de la arteria hepática, se puede llegar a aclarar hasta un 25% más de la insulina. De ahí que se considere al hígado como uno de los órganos más importantes en la regulación de los niveles circulantes de insulina. También los riñones (30-35%) y, el músculo esquelético y tejido adiposo (15%) son responsables, aunque en menor medida, de regular la cantidad de insulina disponible en la circulación arterial (Figura 1).
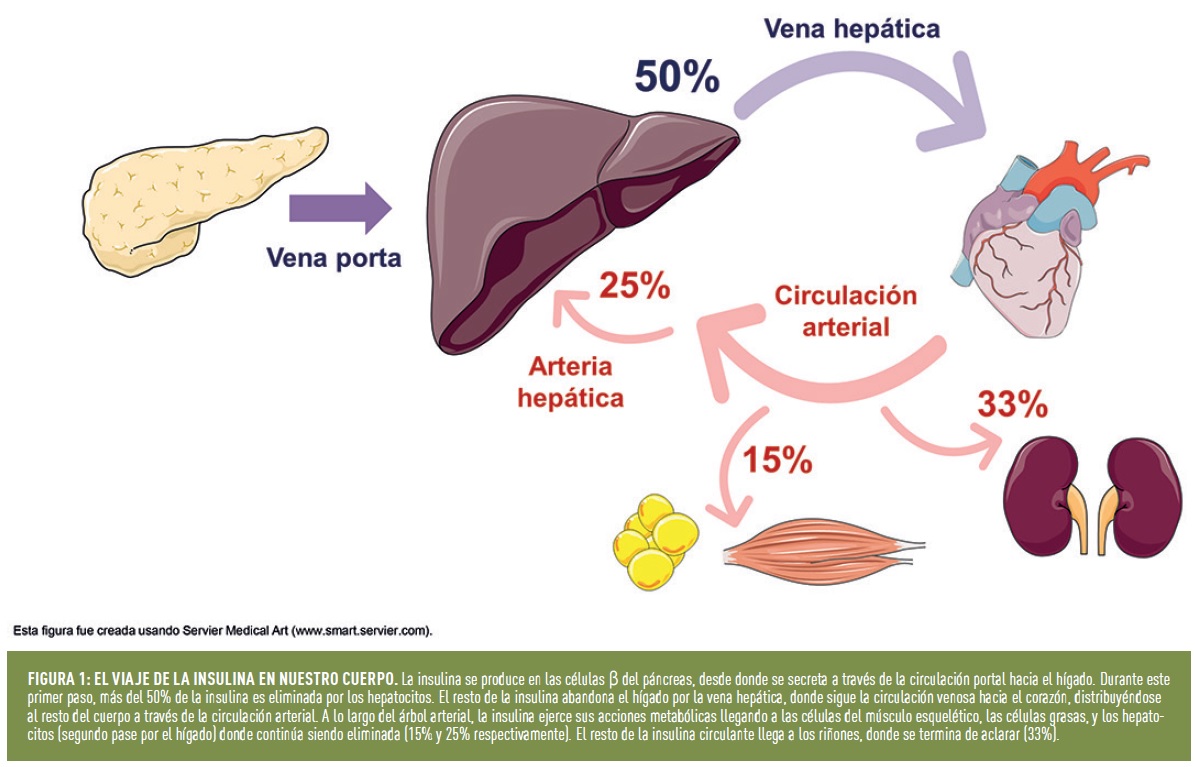
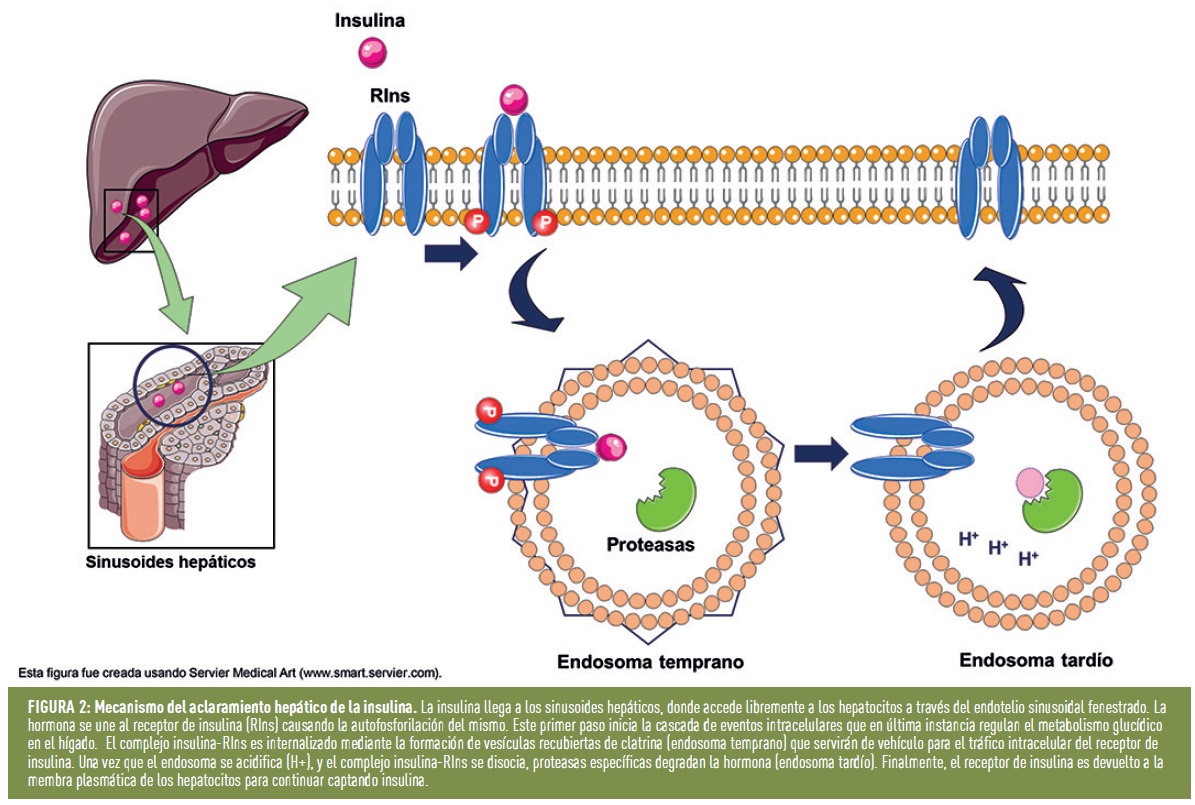
¿Cómo se aclara la insulina en el hígado? La circulación portal lleva la insulina a los capilares de los sinusoides hepáticos permitiendo que se difunda fácilmente desde al espacio perisinusoidal, donde entra en contacto con los hepatocitos, el principal lugar de degradación de la insulina. Sucintamente, el proceso consta de dos pasos: captación y degradación de la hormona. Tras la unión de la hormona a su receptor (receptor de insulina; RIns), ésta es internalizada por el complejo insulina-RIns a través de la formación de una vesícula de transporte denominada endosoma temprano. Los endosomas van a servir como vehículos de transporte y degradación de la insulina dentro de los hepatocitos. La acidificación del interior del endosoma (endosoma tardío) facilitará que la insulina se suelte del receptor, y sea degradada por proteasas específicas. Finalmente, las vesículas que contienen los receptores sin la hormona unida a ellos, son reciclados de vuelta a la membrana plasmática de los hepatocitos, permitiendo que se pueda seguir captando la insulina circulante (Figura 2).
Degradación de la insulina: una cuestión pendiente de resolver
Sabemos muy poco de cómo se regula el aclaramiento de la insulina, particularmente de las proteasas involucradas en la degradación de la hormona. Hace casi 75 años, Mirsky y Broh-Kahn descubrieron la existencia de una actividad proteolítica en extractos de hígado de rata que tenía la capacidad de inactivar la insulina [3]. Con los años, se determinó que esta actividad residía en la insulin-degrading enzyme (IDE), una proteasa dependiente de zinc con una distribución ubicua en los tejidos del cuerpo [4].
Durante todo este tiempo se ha pensado que IDE es la principal proteasa encargada de la degradación de la insulina en los endosomas hepáticos y, por tanto, una diana farmacológica potencial en el tratamiento de la diabetes [4]. La idea es conceptualmente bien sencilla, la inhibición farmacológica de la IDE puede ser beneficiosa al disminuir el aclaramiento de insulina y, por tanto, aumentar la disponibilidad de insulina endógena, lo que llevaría a una reducción de los niveles de glucosa en la sangre de los pacientes con diabetes. Numerosas investigaciones en modelos animales y estudios en humanos apoyaban esta idea. Así, la presencia de polimorfismos dentro o cerca del gen codificante para IDE (Ide) están asociados a una reducción en la capacidad de aclaramiento de la insulina en humanos. También se sabe que las personas con diabetes expresan en menor medida Ide en el hígado. Es más, la hiperinsulinemia presente en la población Afroamericana está asociada a una menor capacidad de aclarar insulina junto con una reducción en la actividad hepática de IDE [5]
Sin embargo, otros estudios han puesto en tela de juicio que la inhibición farmacológica de IDE pueda ser un tratamiento de la diabetes. De hecho, los polimorfismos genéticos de Ide en humanos también se asocian a una mayor susceptibilidad a desarrollar diabetes y la etnia Afroamericana (con menor capacidad de aclarar insulina) tiene mucho mayor riesgo de desarrollar diabetes que los blancos no hispanos. Más aún, el ratón modificado genéticamente en el que se ha inactivado la expresión de Ide (IDE-KO) desarrolla intolerancia a la glucosa y resistencia a la insulina.
En los últimos años, nuestro grupo ha intentado arrojar luz sobre la función de IDE en el aclaramiento de la insulina y su posible uso como diana terapéutica en el tratamiento de la diabetes. Para ello, hemos desarrollado un ratón transgénico condicional y tejido específico en el que hemos inactivado la expresión de IDE en el hígado (L-IDE-KO). Este modelo de estudio demuestra que la inactivación de IDE no tiene ningún efecto sobre la capacidad de aclarar insulina, ni sobre los niveles circulantes de la hormona. Sin embargo, causa resistencia a la insulina e intolerancia a la glucosa [6,7]. Por otro lado, una ganancia de función hepática de IDE mejora la sensibilidad a la insulina y la tolerancia a la glucosa, sin que se vea alterada la capacidad de aclarar insulina [6].
Estos resultados suponen un cambio de paradigma sobre nuestro conocimiento del aclaramiento de la insulina, planteando nuevas cuestiones aún no resueltas: Si IDE no es la principal proteasa involucrada en la degradación de la insulina, ¿cuál es la proteasa que regula el aclaramiento?, ¿cuál es la principal función de IDE?, ¿por qué su inactivación causa resistencia a la insulina?, y dado que IDE participa en la etiología de la resistencia insulínica ¿la búsqueda de fármacos activadores de IDE podría mejorar la sensibilidad a la insulina?
PARECE EVIDENTE QUE, EN LAS PRÓXIMAS DÉCADAS, EL ACLARAMIENTO DE LA INSULINA ATRAERÁ LA SUFICIENTE ATENCIÓN, TANTO EN EL ÁMBITO CLÍNICO COMO EXPERIMENTAL
¿Cuál es la relevancia del aclaramiento de la insulina en la génesis de la diabetes?
Resulta paradójico que una fracción tan grande de la insulina secretada se elimine durante el primer paso de la hormona por el hígado, y que sólo una parte de la nueva insulina secretada entre en la circulación sistémica. Además, los niveles de insulina en ayunas y la sensibilidad a la hormona están fuertemente correlacionados con la extracción hepática durante el primer paso [8], y el aclaramiento está reducido tanto en pacientes obesos como en pacientes con diabetes [9]. Estas observaciones apoyan la noción de que debe existir una razón teleológica para el diseño del aclaramiento hepático de la insulina en términos de protección del organismo.
Bergman y cols, han planteado la hipótesis de que la reducción en la degradación hepática de la insulina es una causa más de la resistencia a la insulina [10]. La reducción del aclaramiento de la hormona conduciría a una hiperinsulinemia, exacerbando la resistencia periférica a la insulina al sobreexponer los tejidos periféricos a niveles elevados de la hormona. Al mismo tiempo, la resistencia a la insulina induciría el sobreesfuerzo de las células β-pancreáticas, contribuyendo al fallo de las mismas en los pacientes con diabetes.
Por el contrario, DeFronzo y cols, plantean la hipótesis opuesta, proponiendo que la disminución de la extracción hepática de insulina es una respuesta compensatoria para contrarrestar el defecto de secreción de insulina. Así, en los estados de resistencia insulínica, como la obesidad y la diabetes, la reducción de la extracción de la hormona es un mecanismo importante que contribuiría a la hiperinsulinemia compensatoria en un intento de mantener la homeostasis normal de la glucosa [9].
Perspectivas futuras
Parece evidente que, en las próximas décadas, el aclaramiento de la insulina atraerá la suficiente atención, tanto en el ámbito clínico como experimental, para comprender la relevancia de este proceso fisiológico en el contexto de la diabetes. Para ello, será necesario despejar las incertidumbres existentes sobre los mecanismos moleculares, celulares y fisiológicos que regulan el aclaramiento de esta hormona. La tarea no es trivial, y el resultado, sea cual fuere, tendrá una gran repercusión en el diseño de nuevas intervenciones preventivas y terapéuticas para el tratamiento de la diabetes.
Bibliografía
- Ferrannini, E. A Journey in Diabetes: From Clinical Physiology to Novel Therapeutics: The 2020 Banting Medal for Scientific Achievement Lecture. Diabetes 2021, 70, 338-346, doi:10.2337/dbi20-0028.
- Stevenson, R.W.; Cherrington, A.D.; Steiner, K.E. The relationship between plasma concentration and disappearance rate of immunoreactive insulin in the conscious dog. Hormone and metabolic research = Hormon- und Stoffwechselforschung = Hormones et Metabolisme 1985, 17, 551-553, doi:10.1055/s-2007-1013604.
- Mirsky, I.A.; Broh-Kahn, R.H. The inactivation of insulin by tissue extracts; the distribution and properties of insulin inactivating extracts. Archives of Biochemistry 1949, 20, 1-9.
- Leissring, M.A.; González-Casimiro, C.M.; Merino, B.; Suire, C.N.; Perdomo, G. Targeting Insulin-Degrading Enzyme in Insulin Clearance. International Journal of Molecular Sciences 2021, 22, doi:10.3390/ijms22052235.
- Fosam, A.; Sikder, S.; Abel, B.S.; Tella, S.H.; Walter, M.F.; Mari, A.; Muniyappa, R. Reduced Insulin Clearance and Insulin-Degrading Enzyme Activity Contribute to Hyperinsulinemia in African Americans. The Journal of Clinical Endocrinology and Metabolism 2020, 105, e1835-1846, doi:10.1210/clinem/dgaa070.
- Villa-Pérez, P.; Merino, B.; Fernández-Díaz, C.M.; Cidad, P.; Lobatón, C.D.; Moreno, A. et al. Liver-specific ablation of insulin-degrading enzyme causes hepatic insulin resistance and glucose intolerance, without affecting insulin clearance in mice. Metabolism: Clinical and Experimental 2018, 88, 1-11, doi:10.1016/j.metabol.2018.08.001.
- Merino, B.; Fernández-Díaz, C.M.; Parrado-Fernández, C.; González-Casimiro, C.M.; Postigo-Casado, T.; Lobatón, C.D. et al. Hepatic insulin-degrading enzyme regulates glucose and insulin homeostasis in diet-induced obese mice. Metabolism: Clinical and Experimental 2020, 113, 154352, doi:10.1016/j.metabol.2020.154352.
- Asare-Bediako, I.; Paszkiewicz, R.L.; Kim, S.P.; Woolcott, O.O.; Kolka, C.M.; Burch, M.A. et al. Variability of Directly Measured First-Pass Hepatic Insulin Extraction and Its Association With Insulin Sensitivity and Plasma Insulin. Diabetes 2018, 67, 1495-1503, doi:10.2337/db17-1520.
- Gastaldelli, A.; Abdul Ghani, M.; DeFronzo, R.A. Adaptation of Insulin Clearance to Metabolic Demand Is a Key Determinant of Glucose Tolerance. Diabetes 2021, 70, 377-385, doi:10.2337/db19-1152.
- Bergman, R.N.; Piccinini, F.; Kabir, M.; Kolka, C.M.; Ader, M. Hypothesis: Role of Reduced Hepatic Insulin Clearance in the Pathogenesis of Type 2 Diabetes. Diabetes 2019, 68, 1709-1716, doi:10.2337/db19-0098.







