La fabricación de islotes pancreáticos funcionales a partir de células madre pluripotentes podría convertirse en una fuente renovable de células para el tratamiento de la diabetes. Al mismo tiempo, estas células sirven como modelo para entender los mecanismos moleculares que desencadenan la diabetes y utilizarse para buscar nuevos fármacos para su tratamiento.
Desde el desarrollo hace 20 años del protocolo de Edmonton [1], los trasplantes de islotes pancreáticos, donde se encuentran las células beta productoras de insulina, constituyen una terapia prometedora para las personas con diabetes tipo 1. A pesar de los resultados positivos, esta terapia ha tenido un impacto limitado debido a la escasez de donantes de islotes, ya que se requiere un gran número de islotes que hacen necesario dos o más donantes para cada trasplante. Gracias a los avances en terapias basadas en el reemplazo celular usando células madre pluripotentes diferenciadas a islotes pancreáticos, actualmente existen varios ensayos clínicos que exploran la posibilidad de usar estos “islotes fabricados” como una alternativa a los islotes de donantes [2].
Fabricando islotes pancreáticos en el laboratorio
Las células madre humanas pluripotentes se caracterizan por tener dos propiedades principales: autorenovación, que les permite multiplicarse indefinidamente en condiciones de cultivo, y pluripotencia, que les permite diferenciarse a cualquier tipo celular del cuerpo con las señales adecuadas.
Los progresos en la diferenciación de células del islote pancreático a partir de células madre se basan en mejorar los protocolos de diferenciación, complicadas recetas que replican en una placa de cultivo las señales que guían el desarrollo del páncreas humano. Éstos protocolos han sido desarrollados basados en el conocimiento obtenido de la biología del desarrollo del páncreas, que ha permitido descifrar el ambiente de señalización dinámico que es requerido para la determinación del páncreas, la formación de células endocrinas y la especificación de células beta [3]. Con esta información, distintos equipos de investigación han hallado de manera empírica la receta de factores de crecimiento y moléculas señalizadoras, junto con sus dosis y tiempos de aplicación, que reproducen las instrucciones del desarrollo in vitro de una manera eficiente, y que conduce a la generación de islotes pancreáticos.
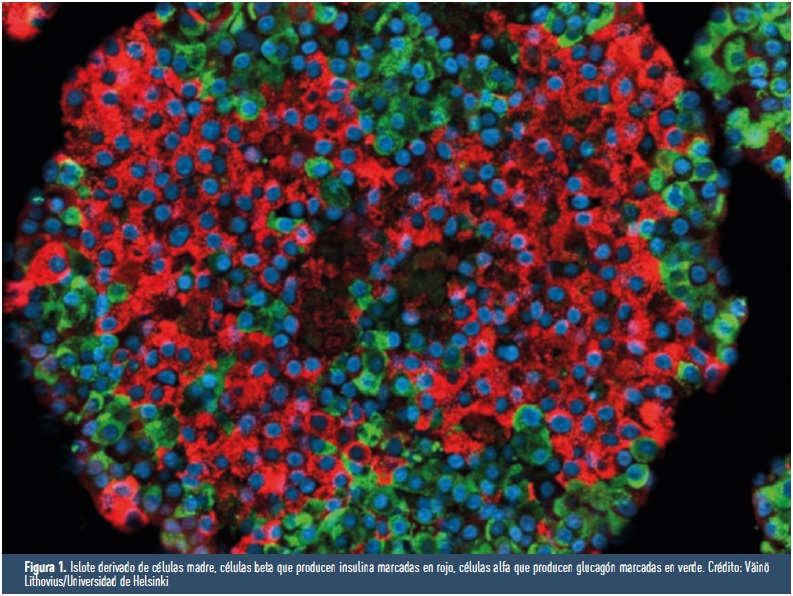
Uno de los objetivos más importantes en la fabricación de islotes pancreáticos a partir de células madre es que se asemejen todo lo posible a los islotes presentes en el páncreas adulto. La idea es que sean tan efectivos para controlar los niveles de glucosa como los islotes reales y se puedan utilizar de manera fiable como un banco de pruebas para buscar nuevos fármacos y entender los mecanismos de la enfermedad. Recientemente, se han obtenido interesantes progresos en la generación de islotes pancreáticos funcionales a partir de células madre y en su caracterización y comparación extensiva con islotes primarios adultos obtenidos de donantes (Figura 1). Estos análisis demostraron que los islotes derivados de células madre funcionan de manera similar a los islotes de donante, secretando insulina en respuesta a glucosa de forma reproducible, y que se asemejan en su forma y el tipo de células que contienen [4].
GRACIAS A LOS AVANCES EN TERAPIAS BASADAS EN EL REEMPLAZO CELULAR USANDO CÉLULAS MADRE PLURIPOTENTES DIFERENCIADAS A ISLOTES PANCREÁTICOS, ACTUALMENTE EXISTEN VARIOS ENSAYOS CLÍNICOS QUE EXPLORAN LA POSIBILIDAD DE USAR ESTOS “ISLOTES FABRICADOS” COMO UNA ALTERNATIVA A LOS ISLOTES DE DONANTES
Descifrar las causas moleculares de la diabetes usando células madre
La diabetes se caracteriza por elevados niveles de glucosa en sangre como resultado de una producción insuficiente de insulina por parte de las células beta del islote pancreático. Mientras que en la diabetes tipo 1 las células beta son destruidas por el sistema inmune, en la diabetes tipo 2 las células beta se tornan disfuncionales. Ambos tipos de diabetes están causados por factores genéticos y ambientales que en concierto desencadenan la enfermedad.
También podemos encontrar un tipo de diabetes mucho más infrecuente, la diabetes monogénica, que es causada solamente por un defecto genético único. Estos defectos, mutaciones en la secuencia de ADN, impactan en genes que codifican o regulan la expresión de proteínas esenciales para el correcto desarrollo y funcionamiento del islote pancreático.
Distintos modelos experimentales se han usado en las últimas décadas para estudiar los mecanismos moleculares detrás de los distintos tipos de diabetes. Numerosos modelos animales, sobre todo ratones, han permitido esclarecer que ocurre con los islotes pancreáticos durante el desarrollo de la diabetes. Sin embargo, los modelos animales tienen importantes limitaciones, ya que ni la genética, ni el metabolismo, ni la fisiología del islote pancreáticos son exactamente iguales entre estos animales y la especie humana [5].
Para entender adecuadamente qué mecanismos están detrás de la disfunción de las células beta en humanos, necesitamos modelos celulares humanos que sean fisiológicamente relevantes. Ante esta necesidad, la generación de células beta a partir de células madre se está erigiendo como una interesante alternativa para poder modelar en el laboratorio procesos fisiopatológicos que resultan en diabetes. Usando células madre derivadas de personas con diabetes monogénica se ha podido investigar cuál es el rol de las mutaciones que la causan, entendiendo mejor qué es lo que está fallando y permitiendo diseñar posibles intervenciones terapéuticas [6]. Además, nuevas herramientas que permiten la edición del genoma de las células madre han permitido mejorar estos modelos y obtener respuestas más claras sobre los mecanismos de la diabetes.
PARA ENTENDER ADECUADAMENTE QUÉ MECANISMOS ESTÁN DETRÁS DE LA DISFUNCIÓN DE LAS CÉLULAS BETA EN HUMANOS, NECESITAMOS MODELOS CELULARES HUMANOS QUE SEAN FISIOLÓGICAMENTE RELEVANTES
Edición del genoma con herramientas CRISPR-Cas9 para generar modelos de diabetes
La edición del genoma con CRISPR-Cas9 se basa en el uso de unas enzimas que permiten cortar la cadena de DNA en regiones específicas y determinadas del genoma. Estos cortes específicos pueden resultar en la disrupción de la función de un gen de interés, por ejemplo asociado al desarrollo de diabetes, o se pueden utilizar para corregir mutaciones en el genoma de las células derivadas de una persona con diabetes monogénica. El desarrollo de las herramientas CRISPR-Cas9 ha supuesto una revolución en el campo de la biotecnología, ya que permiten manipular el genoma con una eficiencia y precisión nunca lograda anteriormente.
El viaje de descubrimiento e implementación de estas herramientas es un bonito ejemplo de cómo hallazgos de investigación básica pueden dar lugar a nuevas tecnologías increíblemente útiles. A principios de los años noventa, el investigador Francis Mojica describió la presencia de unas secuencias repetitivas en el genoma de una bacteria de las salinas de Santa Pola (Alicante), a las que denominó CRISPR [7]. Investigaciones posteriores demostraron que estas secuencias están involucradas en los mecanismos de defensa de las bacterias contra virus bacteriófagos. La descripción en el año 2012 de cómo funcionan los sistemas CRISPR por parte de los laboratorios de Jennifer Doudna y Emmanuelle Charpentier les valió el premio Nobel de química en 2020.
EL SIGUIENTE DESAFÍO ES LA CREACIÓN DE MODELOS CELULARES PARA ESTUDIAR MUTACIONES MÁS COMPLEJAS ASOCIADAS CON DIABETES, SOBRE TODO TIPO 1 Y TIPO 2
La aplicación de CRISPR-Cas9 a células madre ha permitido la corrección de mutaciones que causan enfermedad, la introducción de mutaciones para estudiar su efecto, la regulación de la expresión de genes de interés y la realización de experimentos a gran escala para interrogar la función de los genes. Éstas nuevas posibilidades experimentales son hoy en día utilizadas junto con las células madre para generar modelos celulares que permiten estudiar nuevos mecanismos de la diabetes asociada con mutaciones, tanto en secuencias codificantes, como en secuencias reguladoras del genoma. Esto facilita obtener una idea más precisa de la contribución de estas mutaciones al desarrollo de la diabetes.
El siguiente desafío es la creación de modelos celulares para estudiar mutaciones más complejas asociadas con diabetes, sobre todo tipo 1 y tipo 2. Para ello se necesitarán maneras de introducir múltiples variantes genéticas de una manera eficiente y a escala, en células madre que después se diferenciarán a islotes pancreáticos funcionales. Estos a su vez habrán de exponerse a distintas condiciones de cultivo que recreen los factores ambientales asociados al desencadenamiento de la diabetes.
Bibliografía
- Marfil-Garza BA, Imes S, Verhoeff K, et al (2022) Pancreatic islet transplantation in type 1 diabetes: 20-year experience from a single-centre cohort in Canada. Lancet Diabetes Endocrinol. https://doi.org/10.1016/S2213-8587(22)00114-0
- de Koning EJP, Carlotti F (2021) Stem cell-based islet replacement therapy in diabetes: A road trip that reached the clinic. Cell Stem Cell 28:2044–2046. https://doi.org/10.1016/J.STEM.2021.11.008
- Larsen HL, Grapin-Botton A (2017) The molecular and morphogenetic basis of pancreas organogenesis. Semin Cell Dev Biol. https://doi.org/10.1016/j.semcdb.2017.01.005
- Balboa D, Barsby T, Lithovius V, et al (2022) Functional, metabolic and transcriptional maturation of human pancreatic islets derived from stem cells. Nat Biotechnol 2022 1–14. https://doi.org/10.1038/s41587-022-01219-z
- Nair G, Hebrok M (2015) Islet formation in mice and men: lessons for the generation of functional insulin-producing β-cells from human pluripotent stem cells. Curr Opin Genet Dev 32:171–180. https://doi.org/10.1016/j.gde.2015.03.004
- Balboa D, Iworima DG, Kieffer TJ (2021) Human Pluripotent Stem Cells to Model Islet Defects in Diabetes. Front Endocrinol (Lausanne) 12:642152. https://doi.org/10.3389/fendo.2021.642152
- Mojica FJM, Montoliu L (2016) On the Origin of CRISPR-Cas Technology: From Prokaryotes to Mammals. Trends Microbiol 24:811–820. https://doi.org/10.1016/j.tim.2016.06.005







