El santo grial de la insulinoterapia, para disminuir el riesgo de complicaciones crónicas y de hipoglucemia, sería conseguir insulinas sensibles a la de glucosa, que actuarían en caso de hiperglucemia y cesarían su acción tras alcanzar la normoglucemia, lo que favorecería mantener un mayor tiempo de glucosa en rango.
Es preferible utilizar el término insulina sensible a la glucosa (ver tabla 1), y no el de insulina inteligente, dado que no se ajusta a las acepciones de dicho adjetivo que podemos encontrar en el diccionario de la Real Academia de la lengua española, al no estar dotada la insulina de inteligencia ni estar controlada por una computadora.

El concepto que está más cerca de conseguirlo es el basado en sistemas mecánicos, es decir, en páncreas artificiales. En la actualidad, existen sistemas híbridos que, mediante un algoritmo de control, y de acuerdo con la información que proporciona un sistema de medición continua de glucosa, modifican automáticamente la administración de insulina de una bomba subcutánea continua de insulina. El usuario, debe seguir administrándose el bolo de insulina antes de cada ingesta, y puede indicar, en función de cada sistema, cuando va a hacer ejercicio o si va a dormir, o ajustar ciertos parámetros del sistema de infusión o de los objetivos de control. Con estos sistemas, se consigue en ensayos clínicos y vida real, alcanzar más de un 70% del tiempo de glucosa en rango, con un bajo porcentaje de glucemia por debajo de 70 mg/dl.
Sin embargo, el páncreas artificial, presenta varias limitaciones:
- Retraso absorción y acción de la insulina.
- Duración de los sets de infusión.
- Rechazo por efecto “prótesis”.
- Retardo de la información de la medición continua de glucosa.
- Posibles fallos hardware/software.
- Costes elevados.
- Dificultad para su implantación masiva.
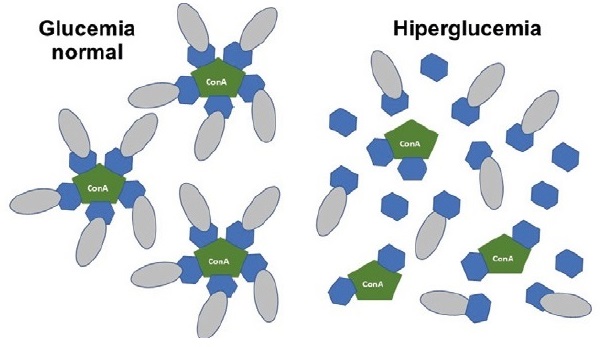
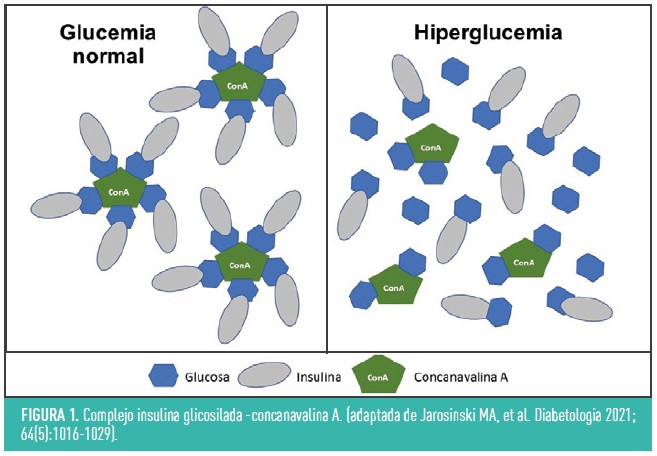
El primer concepto de insulina sensible a la glucosa se publicó en 1979, y se basaba en una molécula de insulina modificada, unida a una lectina llamada concanavalina A (figura 1). Esta lectina, es una proteína que se une a carbohidratos, como la glucosa, y que en este caso actuaría como “sensor”: en presencia de una mayor concentración de glucosa, se produciría una mayor liberación de la insulina de este complejo. El problema, es que los estudios in vitro demostraron que el efecto hipoglucemiante se producía con glucemias más elevadas de las esperadas, que el polímero no era biodegradable y la concanavalina A tenía efectos inmunogénicos y mitogénicos, haciendo inviable el desarrollo clínico de esta molécula.
Desde entonces, se han desarrollado una gran cantidad de conceptos alternativos de insulinas sensibles a la glucosa, con miles de ensayos “in vitro” y patentes, pero hasta el día de hoy, solo unos cientos de moléculas han sido testadas en animales, y tan solo 2 moléculas han sido analizadas en personas.
Estas insulinas sensibles a la glucosa, pueden ser matrices basadas en polímeros o sistemas intrínsecos. Los conceptos basados en polímeros, como la molécula comentada previamente, la insulina queda “secuestrada” dentro de una matriz, que contiene una molécula que ejerce de “sensor”, liberándose la insulina de la matriz de forma proporcional al aumento de la glucemia.
Otra forma de matriz basada en polímeros, son los parches intradérmicos de microagujas de insulina.
Las insulinas sensibles intrínsecas, son derivados de insulina modificados para actuar en función de la glucemia, como las insulinas de fusión con proteínas, sistemas inspirados en la biología, derivados de insulina modificados con ácido fenilborónico, o interruptores conformacionales regulados por glucosa.
Para el desarrollo de estas insulinas, hay retos importantes que superar para que estén disponibles para su uso clínico: deben detectar la glucemia de forma selectiva; no dar lugar a efectos secundarios por toxicidad de alguno de sus componentes; han de responder en el rango de glucemia fisiológica y reaccionar de forma rápida y reversible a los cambios en la glucosa, ejerciendo su acción solo cuando suba la glucemia.
El paso “in vitro” a “in vivo”, ha sido de momento insatisfactorio, ya que ninguna de las moléculas testadas cumple todos los requisitos para lograr un efecto sensible a la glucosa. En personas, todavía no se ha pasado de la fase I de investigación de fármacos, en la que se evalúa la seguridad, la dosis necesaria y se trata de identificar los posibles efectos secundarios. La primera insulina sensible a la glucosa estudiada en personas, la insulina MK-2640, no demostró resultados satisfactorios y se cesó su desarrollo. Existe otra molécula con la que se han realizado ensayos de fase I, pero todavía no se han publicado los resultados.
También están en desarrollo preclínico, moléculas de glucagón sensibles a la glucosa, con los mismos retos y limitaciones comentados. Estas formulaciones de glucagón sensibles a la glucosa podrían ser de gran utilidad para reducir el riesgo de hipoglucemia en personas tratadas con insulina.
A pesar de los retos, siguen abiertas múltiples vías de investigación, y varios laboratorios farmacéuticos han adquirido a compañías de biotecnología, para avanzar en el desarrollo de estas insulinas sensibles a la glucosa. Los estudios in silico, o simulación de procesos biológicos en una computadora, serán también de gran ayuda para materializar este concepto.
Todavía no se sabe si serán insulinas basales para sustituir la secreción continua de insulina fisiológica, insulinas prandiales para administración previa a una ingesta, o servirán como insulina única para cubrir ambas necesidades.
Tal y como dijo el Dr. Frederick Banting en su discurso tras recibir el premio Nobel por el descubrimiento de la insulina, “la insulina no es una cura, es un tratamiento”. Pero obtener una insulina sensible a la glucosa, permitirá dar un salto de calidad en el tratamiento de la diabetes, con una mejora drástica en el control glucémico y en la calidad de vida de las personas que padecen esta enfermedad.
Bibliografía
- Jarosinski MA, Dhayalan B, Rege N, Chatterjee D, Weiss MA. ‘Smart’ insulin-delivery technologies and intrinsic glucose-responsive insulin analogues. Diabetologia. 2021;64(5):1016–29. Disponible en: https://doi.org/10.1007/s00125-021-05422-6
- Brownlee M, Cerami A. Science. 1979 Dec 7;206(4423):1190–1.
- Hoeg-Jensen T. Review: Glucose-sensitive insulin. Molecular Metabolism. 2021;46:101107. Disponible en: https://www.sciencedirect.com/science/article/pii/S2212877820301812
- Ullah A, Choi HJ, Jang M, An S, Kim GM. Smart Microneedles with Porous Polymer Layer for Glucose-Responsive Insulin Delivery. Pharmaceutics. 2020;12(7). Disponible en: https://www.mdpi.com/1999-4923/12/7/606
- Kaarsholm NC, Lin S, Yan L, Kelly T, van Heek M, Mu J, et al. Engineering Glucose Responsiveness Into Insulin. Diabetes. 2017;67(2):299–308. Disponible en: https://doi.org/10.2337/db17-0577
- Heise T. The future of insulin therapy. Diabetes Research and Clinical Practice. 2021;175. Available from: https://doi.org/10.1016/j.diabres.2021.108820
- Novo Nordisk A/S. A Multiple Dose Study Investigating Pharmacokinetics and Pharmacodynamics of Subcutaneous NNC0363-0845 in Participants With Type 1 Diabetes [Internet]. clinicaltrials.gov; 2021 Dec [citado 20 Sept 2022]. Report No.: NCT05134987. Disponible en: https://clinicaltrials.gov/ct2/show/NCT05134987
- Yu S, Xian S, Ye Z, Pramudya I, Webber MJ. Glucose-Fueled Peptide Assembly: Glucagon Delivery via Enzymatic Actuation. J Am Chem Soc. 2021;143(32):12578-89. Disponible en: https://doi.org/10.1021/jacs.1c04570
- The Nobel Prize in Physiology or Medicine 1923 [Internet]. NobelPrize.org. [citado 20 Sep 2022]. Disponible en: https://www.nobelprize.org/prizes/medicine/1923/banting/lecture