A pesar de llevar más de sesenta años utilizándose, los mecanismos por los que la metformina produce sus efectos antidiabéticos siguen siendo controvertidos. Recientemente, han aparecido una serie de estudios que describen nuevos mecanismos de acción de la metformina. Uno de estos estudios demuestra que la metformina requiere el aumento de una citocina del estrés celular denominada factor de diferenciación de crecimiento 15 o GDF15 (growth differentiation factor 15) para producir sus efectos antidiabéticos. Estos resultados también refuerzan la posibilidad de que la modulación de la vía de GDF15 pueda ofrecer nuevas oportunidades para el tratamiento de la diabetes mellitus tipo 2.
La metformina es el fármaco más prescrito para el tratamiento de la diabetes mellitus tipo 2. Este fármaco, perteneciente a la familia de las biguanidas, actúa principalmente reduciendo la producción hepática de glucosa, que es la principal causa de la hiperglucemia en ayunas en los pacientes con diabetes mellitus de tipo 2. Además, la metformina también aumenta la captación de glucosa en el músculo, sin afectar la secreción de insulina, por lo que no produce hipoglucemias, y tampoco aumenta el peso. Asimismo, este fármaco ha mostrado beneficios reduciendo el riesgo de sufrir cáncer y compensando las complicaciones cardiovasculares asociadas a la diabetes (1).
Hay que remontarse a la Edad Media para encontrar los orígenes de la familia de las biguanidas. Es en esa época cuando para tratar a los pacientes con diabetes se utilizaba en Europa la hierba Galega officinalis, conocida popularmente como galega o ruda cabruna. Ya a finales del siglo XIX se describió que esta hierba era rica en guanidina, por lo que se creía que este compuesto podría ser el responsable de su efecto antidiabético. Pero no fue hasta 1918 cuando se demostró que la guanidina reducía los niveles de glucosa en conejos. Sin embargo, la guanidina resultaba demasiado tóxica para utilizarla en pacientes, por lo que, en 1929, para preservar los efectos antidiabéticos de la guanidina y mejorar su seguridad, se sintetizaron las primeras biguanidas, incluyendo la metformina. Hubo que esperar hasta 1957 para que se completara el primer ensayo clínico que demostraba la eficacia y seguridad de la metformina (2). Desde entonces, en sus más de 60 años de uso, este fármaco ha demostrado ser un antidiabético eficaz, con un muy buen perfil de seguridad, y asequible. Estas características le han llevado a ser el fármaco más empleado para el tratamiento de la diabetes mellitus tipo 2, siendo utilizado anualmente por más de 150 millones de personas en todo el mundo.
A pesar del amplio uso de la metformina, los mecanismos responsables de sus efectos antidiabéticos tan sólo han sido revelados en parte y siguen siendo fuente de cierta controversia.
LA ACCIÓN DE LA METFORMINA EN EL INTESTINO SE VE FAVORECIDA POR LA ACUMULACIÓN DE ESTE FÁRMACO EN ESTE ÓRGANO, DONDE ALCANZA CONCENTRACIONES MUCHO MÁS ALTAS QUE EN LA SANGRE. UNA VEZ ALCANZA EL INTESTINO, LA METFORMINA ACTIVA EL CONSUMO DE GLUCOSA COMO FUENTE DE ENERGÍA, ASÍ COMO LA CAPTACIÓN INTESTINAL DE GLUCOSA DE LA CIRCULACIÓN
¿Es el intestino el nuevo órgano diana de la metformina?
Si hasta ahora el hígado era considerado el órgano diana principal responsable de los efectos antidiabéticos de la metformina, diversos estudios aparecidos recientemente parecen indicar que la metformina también tendría acciones muy importantes en el intestino. La acción de la metformina en el intestino se ve favorecida por la acumulación de este fármaco en este órgano, donde alcanza concentraciones mucho más altas que en la sangre. Una vez alcanza el intestino, la metformina activa el consumo de glucosa como fuente de energía, así como la captación intestinal de glucosa de la circulación. Pero, además, la metformina también induce un aumento de la secreción del péptido similar al glucagón tipo 1 o GLP-1 (glucagon-like peptide 1), según su abreviatura en inglés, una hormona de la familia de las incretinas producida por el intestino que reduce los niveles de glucosa a través de numerosas acciones (3). La mayoría de estos efectos de la metformina en el intestino, al igual que en el hígado y en otros órganos, son mediados por la activación de la proteína cinasa activada por AMP o AMPK (AMP-activated protein kinase), un sensor clave de los niveles de energía de las células. Tan importantes parecen ser estas acciones de la metformina en el intestino que algunos autores consideran que este fármaco requiere alcanzar este órgano para ser efectivo como antidiabético. Un estudio publicado recientemente parece confirmar esta posibilidad también en pacientes con diabetes tratados con metformina en los que se ha observado que el intestino es el tejido que más glucosa capta en respuesta al tratamiento con este fármaco. Además, la metformina parece estimular la producción de una serie de metabolitos en el intestino que reducirían la producción hepática de glucosa (4), conectando de esta manera el intestino con el efecto antidiabético principal de este fármaco en el hígado.
Metformina y GDF15
En los últimos años, los efectos antidiabéticos de la metformina también se han relacionado con GDF15. Esta es una citocina cuyos niveles aumentan en situaciones de estrés celular. De hecho, los niveles plasmáticos de GDF15 aumentan en diferentes patologías, especialmente en cáncer, enfermedad cardiovascular, obesidad, diabetes, enfermedades mitocondriales y envejecimiento (5). Por esta razón, GDF15 es utilizado como un biomarcador de la severidad de diversas patologías. Además, GDF15 regula el balance energético y reduce la ingesta de comida. Este efecto anorexígeno de GDF15 es mediado por su receptor GFRAL [glial cell line-derived neurotrophic factor (GDNF) family receptor α-like], que tan sólo se expresa en regiones del cerebro implicadas en el control del apetito y del peso corporal. La demostración de que GDF15 reducía el apetito y el peso corporal se realizó utilizando ratones que carecían del receptor GFRAL. En estos ratones la inyección de GDF15 recombinante no producía la pérdida de peso, mientras que ésta si se observaba en ratones no modificados que expresaban GFRAL.
LA METFORMINA REDUCE EL PESO DE FORMA MODESTA, PERO CON UN IMPACTO SIGNIFICATIVO EN LOS PACIENTES, YA QUE EN LOS PARTICIPANTES CON TOLERANCIA A LA GLUCOSA ALTERADA INCLUIDOS EN EL ENSAYO DIABETES PREVENTION PROGRAMME, LA PÉRDIDA DE PESO ASOCIADA AL TRATAMIENTO CON METFORMINA EXPLICABA MÁS DEL 60% DE REDUCCIÓN DEL RIESGO DE DESARROLLAR DIABETES MELLITUS TIPO 2
El aumento de GDF15 en situaciones como la obesidad y la diabetes mellitus tipo 2 puede considerarse como una respuesta de las células para intentar recuperar el peso y unos niveles adecuados de glucemia. Sin embargo, este aumento de GDF15 en estas patologías no parece ser suficiente para prevenir o revertir su desarrollo. Asimismo, la administración de dosis fisiológicas de GDF15 recombinante a ratones obesos no tiene efectos sobre la ingesta o mejora la diabetes mellitus tipo 2. Por el contrario, cuando se administran dosis muy elevadas (supra fisiológicas) de GDF15 recombinante entonces si se observa una reducción de peso y de las alteraciones metabólicas en modelos animales de diabetes mellitus tipo 2 inducida por obesidad. Estos datos parecen indicar la presencia de resistencia a los efectos de GDF15 en estados de obesidad, de forma similar a lo que ocurre con la resistencia a la insulina en la diabetes mellitus tipo 2. Un estudio muy reciente parece haber encontrado una razón para esta falta de acción de GDF15 durante la obesidad. Según este estudio, la resistencia a GDF15 podría ser mediada por la metaloproteinasa 14, que regula negativamente el receptor GFRAL. De hecho, la activación de la metaloproteinasa 14 en ratones obesos inactiva GFRAL, por lo que GDF15 perdería sus acciones anorexígenas (6). El descubrimiento de este mecanismo supone una nueva alternativa para el tratamiento tanto de la obesidad como de la diabetes mellitus tipo 2 mediante el desarrollo de fármacos inhibidores de la metaloproteinasa 14
EL AUMENTO DE GDF15 EN SITUACIONES COMO LA OBESIDAD Y LA DIABETES MELLITUS TIPO 2 PUEDE CONSIDERARSE COMO UNA RESPUESTA DE LAS CÉLULAS PARA INTENTAR RECUPERAR EL PESO Y UNOS NIVELES ADECUADOS DE GLUCEMIA
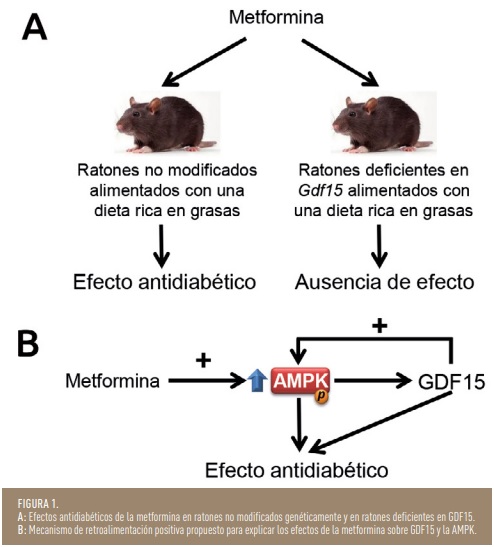
La metformina reduce el peso de forma modesta, pero con un impacto significativo en los pacientes, ya que en los participantes con tolerancia a la glucosa alterada incluidos en el ensayo Diabetes Prevention Programme, la pérdida de peso asociada al tratamiento con metformina explicaba más del 60% de reducción del riesgo de desarrollar diabetes mellitus tipo 2. Las razones de esta pérdida de peso asociada a la utilización de metformina no eran bien conocidas, pero en 2017 un estudio clínico reveló que la metformina aumentaba los niveles de GDF15 en pacientes (7). Posteriormente, dos estudios demostraron que la metformina requería la presencia de la vía GDF15-GFRAL intacta para presentar efecto anorexígeno en ratones (8,9). Además, estos dos estudios encontraron una asociación significativa entre el aumento de los niveles circulantes de GDF15 causado por la metformina y la reducción de peso en individuos con o sin diabetes mellitus tipo 2. Sin embargo, se desconocía si GDF15 afectaba directamente a la principal responsable de los efectos antidiabéticos de la metformina, la AMPK. En un estudio reciente, nuestro grupo de investigación ha demostrado que la metformina requiere de la presencia de GDF15 para presentar sus efectos antidiabéticos en ratones obesos (10). En este estudio la metformina presentó efectos antidiabéticos en ratones no modificados alimentados con una dieta rica en grasas, mientras que estos efectos no se observaron en ratones que carecían de GDF15 (Figura 1A). Además, la metformina activó la AMPK en los ratones que poseían GDF15, pero no lo hizo en los ratones que no expresaban esta citocina. De hecho, los resultados de este estudio parecen indicar que existe un sistema de retroalimentación positiva por el que la metformina activa la AMPK, que a su vez aumenta los niveles de GDF15, y finalmente esta citocina contribuiría a mantener activada la AMPK (Figura 1B). Asimismo, en los ratones que carecían de GDF15, la activación de la AMPK estaba reducida en el hígado y en el músculo en comparación con los ratones que expresaban GDF15. Igualmente, en este estudio hemos observado que la metformina requería de la presencia de GDF15 para activar la AMPK en hepatocitos aislados. Puesto que estas células no expresan GFRAL, estos resultados parecen indicar que los efectos de GDF15 sobre la AMPK son independientes del receptor GFRAL. La presencia de estos efectos periféricos de GDF15, independientes de GFRAL, han sido descritos en unos pocos estudios y todavía se desconoce a través de que receptor o vía GDF15 podría mediar estas acciones. Su descubrimiento podría permitir conocer nuevas vías para potenciar la actividad de la AMPK y así mejorar el tratamiento de la diabetes mellitus tipo 2.
En definitiva, en los últimos años se han descubierto toda una serie de nuevos mecanismos a través de los cuales la metformina produce sus efectos antidiabéticos que abarcan desde la participación del intestino hasta el incremento de los niveles de GDF15. Estos nuevos mecanismos nos ayudan a entender mejor cómo funciona este longevo fármaco y abren nuevas posibilidades para el tratamiento farmacológico de la diabetes mellitus tipo 2.
Referencias
- Viollet, B., Guigas, B., Sanz Garcia, N., Leclerc, J., Foretz, M., Andreelli, F. Cellular and molecular mechanisms of metformin: an overview. Clin. Sci. (Lond) 2012;122:253–270
- Sterne, J. Innovations in antidiabetics. nn dimethylamine guanyl guanidine. Maroc. Med. 1957;36:1295–1296.
- He, L. Metformin and Systemic Metabolism. Trends Pharmacol. Sci. 2020;41:868-881.
- Tobar N, Rocha GZ, Santos A, Guadagnini D, Assalin HB, Camargo JA, et al. Metformin acts in the gut and induces gut-liver crosstalk. Proc. Natl. Acad. Sci. U S A. 2023;120:e2211933120.
- Aguilar-Recarte, D., Barroso, E., Palomer, X., Wahli, W., Vázquez-Carrera, M. Knocking on GDF15’s door for the treatment of type 2 diabetes mellitus. Trends Endocrinol. Metab. 2022;33:741-754.
- Chow, C.F.W., Guo, X., Asthana, P., Zhang, S., Wong, S.K.K., Fallah, S., et al. Body weight regulation via MT1-MMP-mediated cleavage of GFRAL. Nat Metab. 2022;4:203-212.
- Gerstein, H.C., Pare, G., Hess, S., Ford, R.J., Sjaarda, J., Raman, K., et al. Growth differentiation factor 15 as a novel biomarker for metformin. Diabetes Care. 2017;40:280-283.
- Coll A.P., Chen, M., Taskar, P., Rimmington, D., Patel, S., Tadross, J.A., et al. GDF15 mediates the effects of metformin on body weight and energy balance. Nature 2020;578:444-448.
- Day, E.A., Ford, R.J., Smith, B.K., Mohammadi-Shemirani, P., Morrow, M.R., Gutgesell, R.M., et al. Metformin-induced increases in GDF15 are important for suppressing appetite and promoting weight loss. Nat. Metab. 2019;1:1202-1208.
- Aguilar-Recarte, D., Barroso, E., Zhang, M., Rada, P., Pizarro-Delgado, J., Peña, L., et al. A positive feedback loop between AMPK and GDF15 promotes metformin antidiabetic effects. Pharmacol Res. 2022;187:106578.