La diabetes es una enfermedad metabólica compleja que abarca un espectro de trastornos con causas multifactoriales. Aunque históricamente se ha clasificado en diabetes tipo 1 (DT1) y tipo 2 (DT2) según sus características clínicas y etiológicas, esta división no refleja plenamente la diversidad de sus formas. También se reconocen formas menos comunes, como las diabetes monogénicas, causadas por mutaciones en un único gen y que representan entre el 1% y el 5% de los casos. A diferencia de la DT1 y DT2, consideradas enfermedades poligénicas con un riesgo genético derivado de la interacción de múltiples variantes en distintos genes, las diabetes monogénicas resultan de alteraciones en un solo gen. Sin embargo, los avances en genética humana han revelado que la distinción entre estas categorías no es absoluta. Variantes genéticas raras pueden influir en el riesgo de desarrollar diabetes poligénicas (1), mientras que el conjunto de variantes genéticas comunes en un individuo (conocido como bagaje poligénico) puede modificar la probabilidad de que una mutación monogénica se manifieste clínicamente. Esto sugiere una conexión más dinámica entre ambos extremos del espectro genético.
Las diabetes monogénicas, generalmente diagnosticadas antes de los 30 años, muestran una notable heterogeneidad dependiendo del gen afectado y del impacto funcional de la mutación. Estas se dividen en tres categorías principales: diabetes neonatal, diabetes sindrómica y diabetes tipo MODY (Maturity Onset Diabetes of the Young).
La diabetes neonatal se presenta con hiperglucemia severa antes de los 6 meses de vida y puede ser transitoria o permanente. Entre los genes más frecuentemente asociados a esta forma se encuentran ABCC8, KCNJ11 e INS. Por otro lado, la diabetes sindrómica ocurre como parte de síndromes multiorgánicos más complejos. Ejemplos incluyen el síndrome de Wolcott-Rallison, causado por mutaciones en EIF2AK3, o la agenesia pancreática congénita, asociada a alteraciones en genes como PDX1 o PTF1A. Tanto las formas neonatales como las sindrómicas son muy infrecuentes.
En contraste, las diabetes tipo MODY representan más del 90% de los casos de diabetes monogénica. Dentro de esta categoría, más del 50% de los casos involucran mutaciones en los genes GCK y HNF1A. Es relevante destacar que muchos subtipos de diabetes monogénicas son candidatos ideales para intervenciones terapéuticas personalizadas, lo que podría mejorar significativamente el manejo de estas condiciones. Sin embargo, la mayoría de los pacientes con diabetes monogénica permanece sin diagnosticar o es diagnosticada erróneamente como DT1 o DT2 (2), lo que implica la pérdida de oportunidades para implementar tratamientos específicos adaptados a sus necesidades.
El papel clave de la célula beta y el desarrollo del páncreas endocrino
La célula beta, encargada de secretar insulina en respuesta a la glucosa, es fundamental en la fisiopatología de todos los tipos de diabetes. Un elevado porcentaje de las formas monogénicas de la enfermedad están asociadas a mutaciones en genes esenciales para el desarrollo embrionario del páncreas endocrino, la diferenciación o la función de las células beta maduras (3). Estas alteraciones genéticas pueden interrumpir etapas clave del desarrollo del páncreas, como la expansión de los progenitores pancreáticos o la diferenciación y maduración de células endocrinas funcionales (Figura 1). Por ello, la comprensión de estos procesos a nivel del desarrollo embrionario humano resulta crítica para desentrañar los mecanismos de muchas formas de diabetes monogénicas.
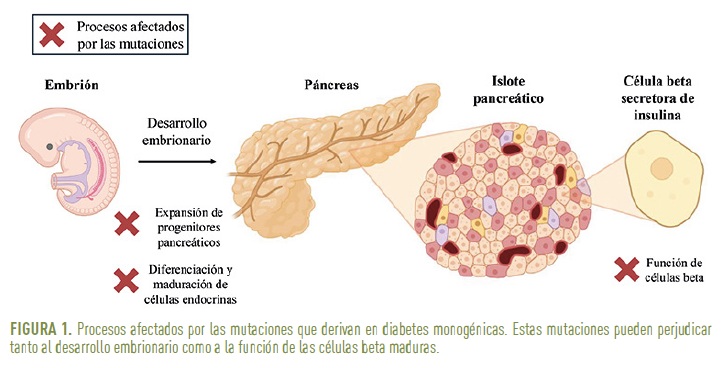
UN ELEVADO PORCENTAJE DE LAS DIABETES MONOGÉNICAS ESTÁN ASOCIADAS A MUTACIONES EN GENES ESENCIALES PARA EL DESARROLLO EMBRIONARIO DEL PÁNCREAS ENDOCRINO O A LA FUNCIÓN DE LAS CÉLULAS BETA MADURAS
Modelos experimentales en el estudio de la diabetes
La investigación en diabetes depende de modelos experimentales que nos permitan comprender su origen, evolución y mecanismos moleculares implicados. A lo largo de la historia, los modelos animales han sido fundamentales en este campo. Desde los experimentos pioneros de Banting y colaboradores, que introdujeron la terapia insulínica hace más de un siglo, hasta el desarrollo de terapias modernas como los agonistas del receptor de GLP-1, estos modelos han sido cruciales para los avances en el tratamiento de la diabetes.

Sin embargo, los modelos animales presentan limitaciones significativas, especialmente para el estudio de las formas monogénicas de diabetes. Aunque roedores y humanos comparten muchas rutas de señalización implicadas en el desarrollo del páncreas, las diferencias son considerables y evitan que podamos trasladar muchos avances realizados en modelos animales. Un ejemplo paradigmático es el recientemente descrito papel del gen ZNF808 (4), el cual no tiene equivalente en el genoma de roedores u otros animales de experimentación y cuyas variantes patogénicas se han asociado a agénesis del páncreas y diabetes monogénica neonatal en humanos. Incluso en el caso de genes compartidos, como HNF1A, modelos animales no reproducen de forma adecuada las características clínicas de la enfermedad humana (5).
Modelos alternativos, como los islotes pancreáticos humanos obtenidos de donantes, ofrecen una mayor proximidad al contexto humano. No obstante, estos modelos también tienen sus propias limitaciones: su disponibilidad es escasa, y resulta inviable utilizarlos como modelo en el caso de diabetes monogénicas debido a la rareza de los casos. Además, los islotes adultos no permiten estudiar el desarrollo embrionario, un aspecto crítico en muchas formas monogénicas de diabetes. Estas restricciones subrayan la necesidad de desarrollar modelos más avanzados para comprender mejor estas enfermedades.
MEDIANTE LA EDICIÓN GENÉTICA CON HERRAMIENTAS COMO CRISPR/CAS9 PODEMOS INTRODUCIR MUTACIONES ESPECÍFICAS EN LAS CÉLULAS MADRE PARA GENERAR MODELOS QUE REPLICAN LAS ALTERACIONES GENÉTICAS ASOCIADAS A LAS DIABETES MONOGÉNICAS
Células madre pluripotentes humanas como modelo alternativo
Las células madre pluripotentes humanas se han convertido en una herramienta revolucionaria para modelar enfermedades humanas. Estas células tienen la capacidad de autorrenovarse indefinidamente y diferenciarse en cualquier tipo celular, incluidos islotes endocrinos que contienen células beta. Este proceso puede ser reproducido en el laboratorio, usando factores de crecimiento y otras moléculas que actúan como agonistas o inhibidores de ciertas rutas de señalización celular, es posible dirigir a las células madre a través de los diferentes estadios del desarrollo pancreático hasta generar agregados endocrinos que contienen células beta. Esto permite reproducir tanto el desarrollo embrionario como los efectos de mutaciones genéticas en un contexto humano. Además, su uso es más accesible y económico comparado con los modelos animales o la obtención de islotes de donantes.
Existen protocolos bien establecidos para diferenciar células madre en células beta funcionales, imitando las etapas del desarrollo pancreático: desde el endodermo definitivo hasta los progenitores pancreáticos y endocrinos, culminando finalmente con la generación de células beta con capacidad de síntesis y secreción de insulina. Aunque en un principio estos protocolos generaban células inmaduras, su reciente optimización permite obtener agregados celulares que emulan parcialmente la arquitectura de los islotes pancreáticos humanos (6), incluyendo interacciones celulares esenciales. Estas células pueden alcanzar un nivel de madurez funcional casi equivalente al de los islotes nativos, posicionándolas como una opción prometedora tanto para la investigación como para aplicaciones terapéuticas.
EXISTEN PROTOCOLOS BIEN ESTABLECIDOS PARA DIFERENCIAR CÉLULAS MADRE PLURIPOTENTES HUMANAS EN CÉLULAS BETA FUNCIONALES, IMITANDO LAS ETAPAS DEL DESARROLLO PANCREÁTICO
De hecho, las terapias basadas en células beta derivadas de células madre están emergiendo como una solución innovadora para tratar la diabetes, particularmente la DT1 (7). Estas terapias buscan restaurar la producción de insulina mediante el reemplazo de las células beta destruidas por células funcionales derivadas de células madre. Más allá de su potencial terapéutico, estas células también constituyen un modelo sin precedentes para investigar los efectos de variantes genéticas en el desarrollo humano, superando las limitaciones de los modelos animales y abriendo nuevas posibilidades en la comprensión de las bases genéticas de la diabetes.
Edición genética y aplicación en diabetes monogénicas
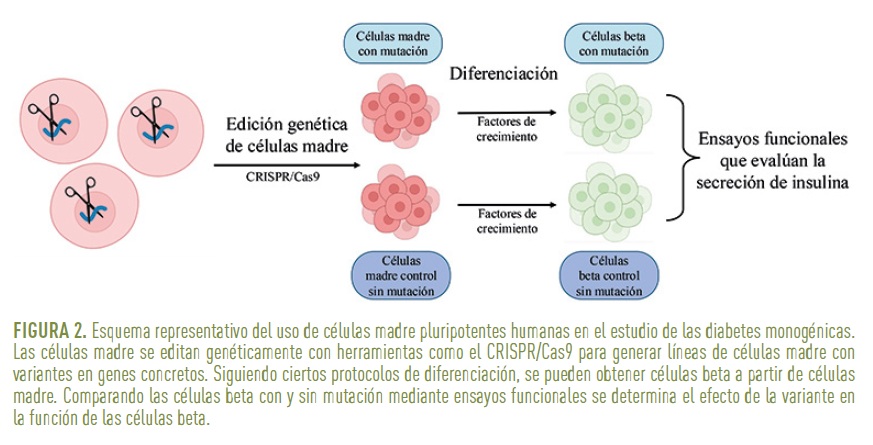
La edición genética mediante herramientas como CRISPR/Cas9 permite introducir mutaciones específicas en las células madre de una manera relativamente sencilla, posibilitando generar modelos que replican fielmente las alteraciones genéticas asociadas a las diabetes monogénicas y encontradas en pacientes. Se han generado líneas con variantes en genes como PDX1, HNF1A o RFX6, entre otros, para estudiar sus efectos en el desarrollo pancreático (8). Estos modelos permiten investigar todas las etapas del desarrollo pancreático, desde las fases iniciales hasta la formación de agregados endocrinos que contienen células beta maduras. Con ellos, es posible realizar ensayos funcionales para evaluar si la secreción de insulina es normal o presenta alteraciones, comparándola con controles sin mutaciones patogénicas (Figura 2).
Además de aportar una comprensión molecular detallada sobre las causas de la diabetes monogénica, estos modelos constituyen una herramienta esencial para probar terapias diseñadas para mejorar la función secretora de insulina en el contexto de mutaciones asociadas a estas formas de diabetes. La edición genética no solo permite estudiar las alteraciones, sino también corregirlas, abriendo la puerta a estrategias terapéuticas futuras. Por ejemplo, en casos de diabetes neonatal permanente causada por mutaciones en el gen de la insulina, sería posible tratar a los pacientes mediante trasplantes de células beta derivadas de células madre con la mutación corregida (9). Esto representa un enfoque potencialmente curativo para algunas formas de diabetes monogénica.
Sin embargo, las células madre pluripotentes también presentan limitaciones. Aunque son una herramienta poderosa para modelar enfermedades, no replican la complejidad de un organismo completo, donde las interacciones con otros tejidos y sistemas desempeñan un papel crítico en la patología. Además, los costos asociados con el mantenimiento de estas líneas y los experimentos de diferenciación siguen siendo elevados, lo que también impacta en la viabilidad económica de las terapias derivadas de células madre (10).
Conclusión
Las células madre pluripotentes humanas son una herramienta revolucionaria para investigar las bases genéticas de la diabetes y modelar la enfermedad en un contexto humano. Su capacidad para reproducir el desarrollo pancreático y las mutaciones genéticas asociadas ofrece nuevas oportunidades para desentrañar los mecanismos moleculares de la enfermedad y avanzar hacia terapias personalizadas. A pesar de retos técnicos y de coste, su potencial para transformar tanto la investigación como el manejo clínico de la diabetes es innegable.
Bibliografía
- Huerta-Chagoya A, Schroeder P, Mandla R, et al. Rare variant analyses in 51,256 type 2 diabetes cases and 370,487 controls reveal the pathogenicity spectrum of monogenic diabetes genes. Nat Genet. 2024;56(11):2370-2379. doi:10.1038/s41588-024-01947-9
- Riddle MC, Philipson LH, Rich SS, et al. Monogenic Diabetes: From Genetic Insights to Population-Based Precision in Care. Reflections From a Diabetes Care Editors’ Expert Forum. Diabetes Care. 2020;43(12):3117-3128. doi:10.2337/dci20-0065
- Bartolomé A. Stem Cell-Derived β Cells: A Versatile Research Platform to Interrogate the Genetic Basis of β Cell Dysfunction. IJMS. 2022;23(1):501. doi:10.3390/ijms23010501
- De Franco E, Owens NDL, Montaser H, et al. Primate-specific ZNF808 is essential for pancreatic development in humans. Nat Genet. 2023;55(12):2075-2081. doi:10.1038/s41588-023-01565-x
- Pontoglio M, Sreenan S, Roe M, et al. Defective insulin secretion in hepatocyte nuclear factor 1alpha-deficient mice. J Clin Invest. 1998;101(10):2215-2222. doi:10.1172/JCI2548
- Balboa D, Barsby T, Lithovius V, et al. Functional, metabolic and transcriptional maturation of human pancreatic islets derived from stem cells. Nature biotechnology. Published online March 2022. doi:10.1038/s41587-022-01219-z
- Shapiro AMJ, Verhoeff K. A spectacular year for islet and stem cell transplantation. Nat Rev Endocrinol. 2023;19(2):68-69. doi:10.1038/s41574-022-00790-4
- Maestas MM, Bui MH, Millman JR. Recent progress in modeling and treating diabetes using stem cell-derived islets. Stem Cells Translational Medicine. 2024;13(10):949-958. doi:10.1093/stcltm/szae059
- Ma S, Viola R, Sui L, Cherubini V, Barbetti F, Egli D. β cell replacement after gene editing of a neonatal diabetes-causing mutation at the insulin locus. Stem cell reports. 2018;11(6):1407-1415. doi:10.1016/j.stemcr.2018.11.006
- Inoue R, Nishiyama K, Li J, et al. The Feasibility and Applicability of Stem Cell Therapy for the Cure of Type 1 Diabetes. Cells. 2021;10(7):1589. doi:10.3390/cells10071589







