Los sensores de glucosa y sistemas de infusión de insulina son dispositivos que permiten medir los niveles de glucosa y administrar la insulina de manera continua y dinámica, disminuyendo así la incidencia de hipoglucemias y mejorando la calidad de vida y control de la enfermedad en personas con diabetes mellitus. A pesar de que son una opción conveniente y segura para el tratamiento de su patología, estos dispositivos contienen metales, aditivos de goma, adhesivos y tintes, por lo cual pueden no ser del todo inocuos para la salud al requerir el contacto prolongado de la piel con el sensor, así como la aplicación repetida de adhesivos para ciclos de uso de hasta 14 días (1, 2, 3).
A pesar de que la dermatitis de contacto es una patología poco frecuente en la población pediátrica española, en los últimos años se ha descrito con mayor frecuencia en niños con el diagnóstico de diabetes mellitus portadores de estos dispositivos, siendo el eccema la reacción adversa dermatológica reportada con mayor frecuencia en relación con ello (4).
En estos dispositivos los alérgenos pueden estar presentes tanto en el adhesivo empleado, como en el propio dispositivo, generando desde reacciones leves como enrojecimiento o prurito localizado en la zona de contacto hasta reacciones más graves con aparición de ampollas, exudado amarillento o reacciones generalizadas (5).
En el año 2017, coincidiendo con la introducción en el mercado de un nuevo monitor de glucosa portátil, el acrilato isobornil (IBOA) fue descrito por primera vez por dermatólogos de Bélgica y Suiza como el alérgeno causal en reacciones por este tipo de dispositivos, seguido por otros alérgenos como diferentes acrilatos y metacrilatos y la colofonia (6,7).
El IBOA es un monómero de acrílico de bajo peso molecular que está presente en recubrimientos, pinturas, tintes, plásticos y adhesivos. Inicialmente se pensaba que las reacciones por IBOA eran de tipo irritativas, ya que con los alérgenos presentes en las baterías de pruebas epicutáneas estándar disponibles en el mercado se obtenían resultados negativos. Además, se pensaba que no tenía capacidad de generar sensibilización alérgica. En la actualidad se sabe que su efecto alergénico había sido subestimado (6,8), siendo identificado como el alérgeno primario en la mayoría de los casos de dermatitis de contacto por sensores de glucosa y bombas de insulina. Por este motivo, en 2020 fue nombrado como Alérgeno del año por la Asociación Americana de Dermatitis de Contacto (1,2). El isobornil no tiene reactividad cruzada con los demás acrilatos y, como se ha comentado, no se incluye de manera habitual en la batería estándar de alérgenos de las pruebas epicutáneas (parches) habituales (9).
LOS ACRILATOS SON PLÁSTICOS SINTÉTICOS UTILIZADOS DE MANERA EXTENSIVA, SIENDO IMPORTANTES AGENTES CAUSALES DE DERMATITIS DE CONTACTO EN PACIENTES PORTADORES DE MONITORES DE GLUCOSA Y SISTEMAS DE INFUSIÓN DE INSULINA
Es de suma importancia, no sólo para las compañías fabricantes de estos dispositivos, sino también para la salud pública, identificar los posibles alérgenos presentes en estos dispositivos, así como la de buscar posibles soluciones para evitar la sensibilización inicial y que se produzcan reacciones alérgicas del tipo dermatitis de contacto y sus complicaciones (1).
Presentamos 13 casos de dermatitis de contacto asociadas a dispositivos de monitorización de glucosa portátil en nuestro centro. Los pacientes tenían una edad mediana de 13 años (rango 5-17 años) y fueron remitidos por el servicio de Endocrinología por presentar lesiones eccematosas en la zona de inserción del sistema de infusión de insulina portátil y/o el dispositivo para monitorización de glucosa (Figura 1).
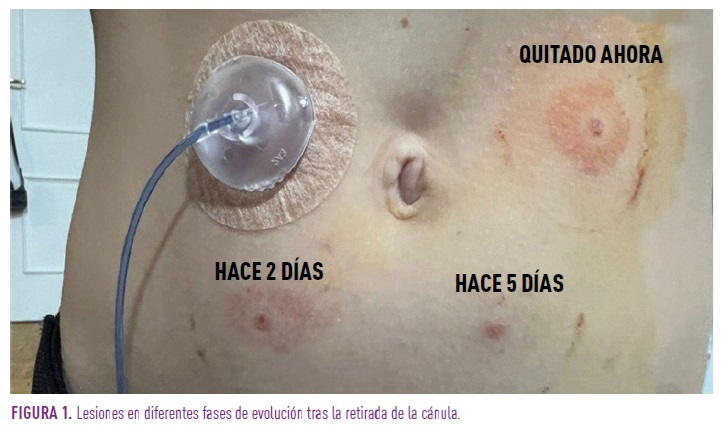
De los 13 pacientes, 10 eran portadores del dispositivo de monitorización Dexcom G6, uno de Freestyle3, uno de Freestyle Libre y un paciente de Medtronic. Todos los pacientes empleaban la bomba de insulina YpsoPump.
El tiempo mediano desde el inicio de uso del dispositivo hasta el inicio de las lesiones de eccema fue de 8 meses (rango 1-14). De estos pacientes, el 30,8% (4/13) tenían antecedentes de dermatitis atópica (Tabla 1).
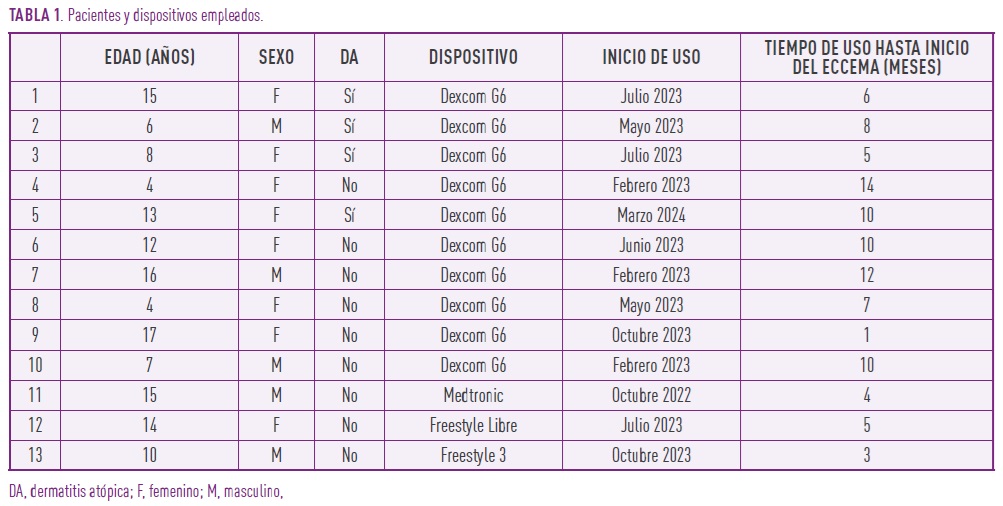
Se realizaron pruebas epicutáneas en parches con batería de acrilatos (MA-100 Series de (met)acrilato: adhesivos, dental y otros, Chemotechnique Diagnostics, Vellinge, Sweden) (Tabla 2) y batería estándar (TruTest 36, Martí Tor, Cervelló, España), con lectura a las 48-72 y 96 horas de su aplicación. Las pruebas con la batería estándar se han realizado hasta el momento en el 23,1% (3/13) de los pacientes. En el resto están pendientes tras haberse realizado primero la batería de acrilatos y no disponer de piel libre para aplicarlos al mismo tiempo. A uno de los pacientes se le hicieron también pruebas con la aplicación directa de adhesivos empleados con los dispositivos.
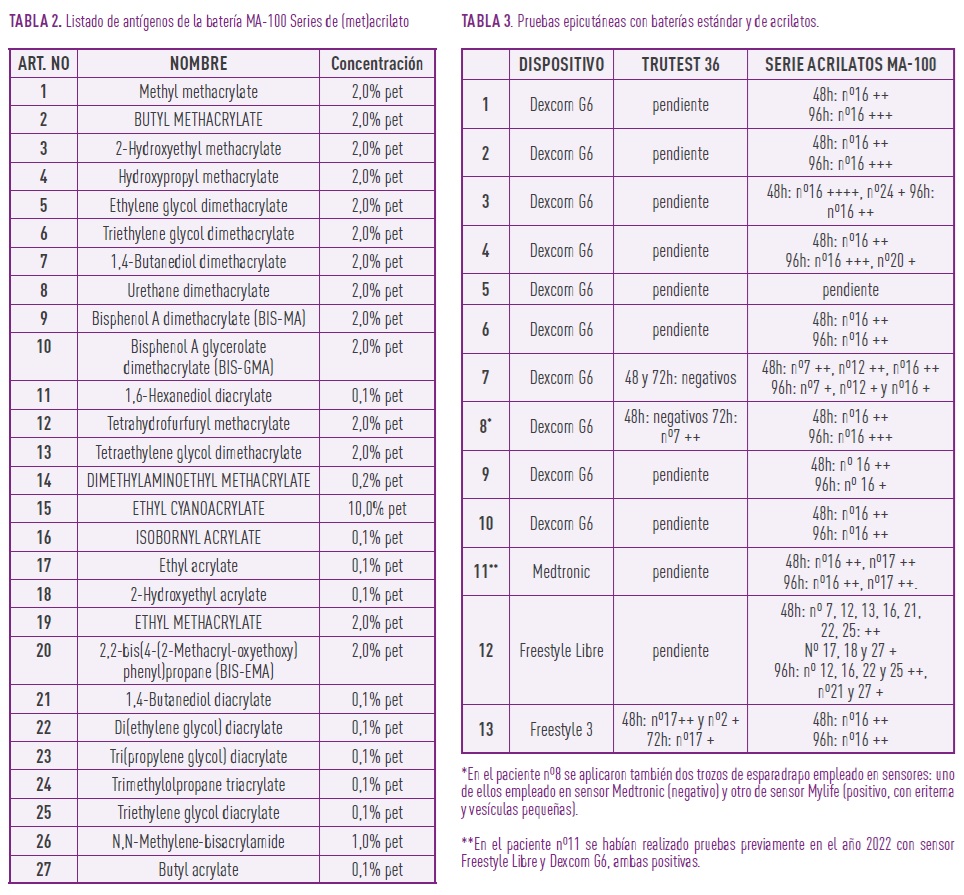
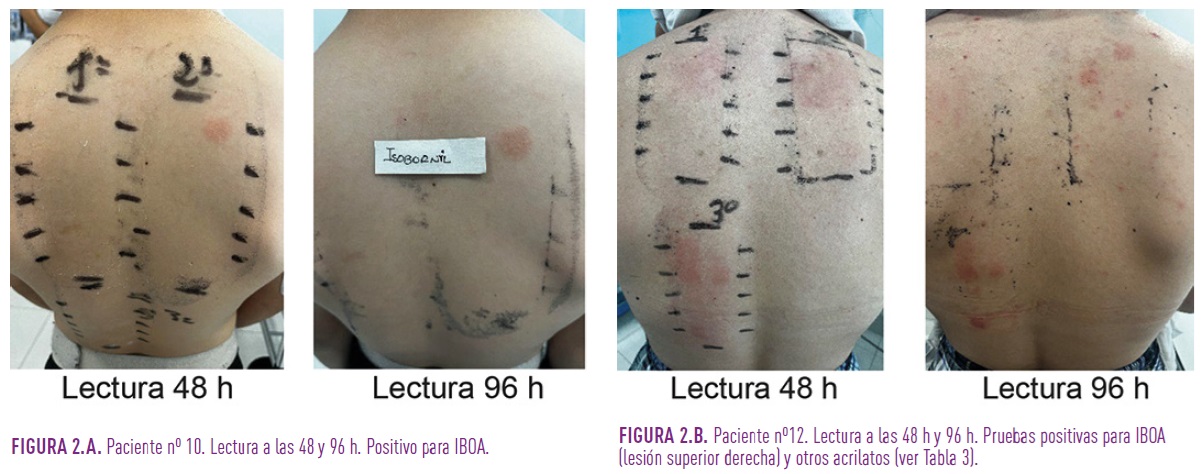
Los 13 pacientes estudiados tuvieron pruebas epicutáneas positivas para el IBOA (Nº16) de la batería de acrilatos tanto a las 48 como a las 96 horas (Tabla 3). En el 38,5% (5/13) de los pacientes también se obtuvieron pruebas positivas para otros acrilatos (1,4-Butanediol dimethacrilato, Tetrahydrofurfuryl methacrilato, Ethyl acrilato, 2,2-bis(4-(2-Methacryl-oxyethoxy)phenyl)propane (BIS-EMA), 1,4-Butanediol diacrilato, Di(ethylene glycol) diacrilato, Triethylene glycol diacrilato y Butyl acrilato). Como ejemplo de los resultados la Figura 2 muestra las pruebas para acrilatos de los Pacientes 10 y 12. En el 66,7% (2/3) de los pacientes las pruebas con la batería estándar resultaron positivas. En el Paciente 8 para colofonia y en el Paciente 13 para Cl+Me- Isotiazolinona en las lecturas realizadas a las 72 horas.
El 23,1% (3/13) de los pacientes habían empleado previamente otros dispositivos presentando igualmente lesiones de eccema. El paciente 8 había utilizado Medtronic, el paciente 13 freestyle libre y freestyle 2, y el paciente 11 freestyle y Glucomen day CGM. Los demás mantenían el mismo dispositivo desde el inicio, realizando tratamiento con corticoides tópicos o con apósitos de coloides como aislante barrera. A pesar de ello seguían presentando lesiones de eccema, aunque más leves.
LA SENSIBILIZACIÓN A ISOBORNIL HA AUMENTADO DESDE EL INICIO DE SU USO EN ESTE TIPO DE SISTEMAS. PARA IDENTIFICAR LA SUSTANCIA RESPONSABLE ES NECESARIO REALIZAR UN ESTUDIO ALERGOLÓGICO MEDIANTE PRUEBAS EPICUTÁNEAS CON EXTRACTOS DE ACRILATOS ESTANDARIZADOS
Discusión
A lo largo de la historia, la dermatitis de contacto por acrilatos y metacrilatos había sido descrita en relación con la exposición ocupacional, productos dentales, uñas acrílicas y apósitos para heridas. De manera general, las reacciones de dermatitis de contacto por el uso de dispositivos de monitorización de glucosa eran descritas con poca frecuencia; sin embargo, en los últimos 10 años ha aumentado el número de casos diagnosticados y publicados. En la mayoría de los pacientes se han descrito lesiones en la zona de contacto con el adhesivo de los dispositivos de las diversas marcas disponibles en el mercado (Freestyle Libre de Abbot, Minimed de Medtronic, Dexcom G6 de Dexcom y Omnipod de Insulet Corporation). Dentro de la mezcla compleja de acrilatos con los que están elaborados, el isobornil acrilato (IBOA) se ha identificado como el alérgeno causal más frecuente (1).
Al analizar dichos dispositivos se ha descrito que el IBOA no se encuentra presente en el parche de adhesivo, sino en el pegamento empleado para unir la parte superior e inferior del sensor. El antígeno se desplaza por arrastre hacia otras partes de este, siendo luego detectado en la parte plástica que contacta con la piel del paciente. No obstante, existen casos descritos de pacientes con pruebas epicutáneas para IBOA muy positivas que tienen pruebas negativas para el adhesivo y el material de soporte plástico del dispositivo. Esto sugiere que la concentración de IBOA en estos componentes debe de ser mínima (5, 9). A pesar de que el IBOA sea el antígeno responsable más frecuente, debe considerarse que el mismo adhesivo puede ser causa de dermatitis de contacto por otros acrilatos y metacrilatos (10).
La incidencia de dermatitis de contacto en los usuarios de estos dispositivos puede alcanzar hasta el 79% en algunas series, teniendo que ser sustituidos por mala tolerancia en la mayoría de los casos. Las lesiones de eccema pueden aparecer semanas o meses después del contacto inicial, generando una sensibilización que acompañará al paciente a lo largo de la vida con reacciones de eccema similares tras cada nueva exposición (2,7). En una serie de 6 casos de edades entre 6-13 años se describió el inicio de la dermatitis tras primer uso del dispositivo en un rango de 1-24 meses (5), periodo que comprende la latencia observada en nuestra serie.
Entre los factores de riesgo para la dermatitis de contacto, además de la dosis de antígeno y el área expuesta, es fundamental el tiempo y duración de la exposición. Este hecho se ha confirmado en pacientes que no toleraban dispositivos de monitorización que requieren aplicaciones de hasta 14 días, pero sí bombas de insulina que precisaban tiempos de exposición menores (6). También deben considerarse como factores de riesgo o facilitadores, la presencia de alteraciones de la barrera epidérmica y la inflamación cutánea crónica. Es por ello que los pacientes con dermatitis atópica o eczema crónico pueden tener mayor riesgo de desarrollar dermatitis de contacto por alguno de los componentes de estos dispositivos. En nuestro caso, hasta el 30% de los pacientes tenían antecedentes de dermatitis atópica.
Al realizar las pruebas epicutáneas es importante tener en cuenta que no existe reactividad cruzada entre el IBOA y los demás acrilatos, ya que su estructura química es diferente; sin embargo, la sensibilización a varios acrilatos puede ocurrir de manera concomitante (4,10). De nuestra serie, el 100% de los pacientes tuvo una prueba positiva para isobornil acrilato en la lectura a las 48 y 96 horas, frecuencia más elevada que la descrita en otros estudios. También se obtuvieron pruebas positivas para otros acrilatos en el 38% de los casos.
Se han creado nuevas versiones de algunos de estos dispositivos libres de IBOA; no obstante, se siguen reportando reacciones tras su uso en algunos pacientes, aunque con buena tolerancia en aquellos que eran alérgicos a IBOA. En el análisis del nuevo dispositivo se encontró una nueva sustancia denominada butilhidroxitolueno (BHT) como posible agente causal. Esta sustancia ha sido descrita previamente como responsable de dermatitis de contacto por cosméticos y medicamentos, aunque únicamente a altas concentraciones (6).
Las estrategias de tratamiento en pacientes con dermatitis de contacto por sensores de glucosa y sistemas de infusión de insulina son la aplicación de emolientes o apósitos cutáneos, así como corticoides tópicos o inhibidores de calcineurina localmente, aunque existe la preocupación de que puedan intervenir con el correcto funcionamiento del sensor y del dispositivo. También se ha descrito que el uso de apósitos tipo Compeed, Stomahesive (Convatec) o de apósitos con hidrocoloides pueden servir para prevenir que los alérgenos del dispositivo penetren en la piel sin afectar el funcionamiento del sensor. Sin embargo, en la mayoría de los casos las lesiones de eccema no son evitadas por completo, manteniéndose con frecuencia lesiones leves.
Conclusiones
Los acrilatos son plásticos sintéticos utilizados de manera extensiva, siendo importantes agentes causales de dermatitis de contacto. La sensibilización a isobornil ha aumentado desde el inicio de su uso en los sensores de glucosa y sistemas de infusión de insulina. Para identificar la sustancia responsable es necesario realizar pruebas epicutáneas con extractos de acrilatos estandarizados. Las pruebas epicutáneas realizadas sólo con el adhesivo del dispositivo se asocian a falsos negativos.
En el momento del diagnóstico se debe tener en cuenta que algunas de las baterías de pruebas epicutáneas disponibles (baterías estándar, de pegamentos y plásticos o de acrilatos) no incluyen el isobornil ni los metacrilatos entre sus alérgenos. Por ello, para asegurar el correcto estudio de cada caso deben desarrollarse baterías que incluyan estos compuestos.
El tratamiento de la dermatitis de contacto por antígenos de los componentes de los dispositivos que no puedan ser eliminados es la creación de barreras para la piel que limiten el contacto con ella.
Los médicos deben conocer la posibilidad de que se produzcan reacciones cutáneas alérgicas al usar estos monitores y dispositivos, así como la indicación de consulta a Alergología para su estudio.
Por último, la presencia de algunas de estas sustancias no se incluye entre los componentes enumerados en el empaquetado de estos dispositivos. Esto limita la identificación del agente o agentes causales y por otro lado dificulta la elección de los materiales alternativos una vez realizado el diagnóstico. Las autoridades sanitarias deben asegurar la monitorización continua de las sustancias empleadas en la fabricación de estos dispositivos, su correcta identificación, así como la detección de nuevos alérgenos para extremar la vigilancia de aparición de nuevos casos.
Bibliografía
- Khatsenko K, Khin Y, Maibach H. Allergic Contact Dermatitis to Components of Wearable Adhesive Health Devices. Dermatitis. 2020;31(5):283-286. doi: 10.1097/DER.0000000000000575. PMID: 32209871.
- Arasu A, Ross G. Treatment of generalised isobornyl acrylate contact allergy from diabetes pump with Dupilumab. Australas J Dermatol. 2022;63(1):e91-e93. doi: 10.1111/ajd.13740. PMID: 34751430.
- Herman A, Aerts O, Baeck M, Bruze M, De Block C, Goossens A, Hamnerius N, Huygens S, Maiter D, Tennstedt D, Vandeleene B, Mowitz M. Allergic contact dermatitis caused by isobornyl acrylate in Freestyle® Libre, a newly introduced glucose sensor. Contact Dermatitis. 2017 Dec;77(6):367-373. doi: 10.1111/cod.12866. Epub 2017 Aug 14. PMID: 28804907.
- Joyanes Romo JB, Borja Segade JM, Moreno Lozano L, García Rodríguez R, González Jiménez OM, Palacios Cañas A, Meneses Sotomayor JV, Gómez Torrijos E. Contact Dermatitis Caused by Glucose Sensors: More Than Allergy to Isobornyl Acrylate. J Investig Allergol Clin Immunol. 2022;32(3):232-233. doi: 10.18176/jiaci.0739. PMID: 34489217.
- Mowitz M, Fornander L, Hosseiny S, Ryberg K, Bruze M. Patch Testing with Isobornyl Acrylate in 16 Swedish Patients with Contact Dermatitis from Glucose Sensors and/or Insulin Pumps. Acta Derm Venereol. 2019;99(13):1286-1287. doi: 10.2340/00015555-3256. PMID: 31289841.
- Aerts O, Herman A, Mowitz M, Bruze M, Goossens A. Isobornyl Acrylate. Dermatitis. 2020;31(1):4-12. doi: 10.1097/DER.0000000000000549. PMID: 31913984
- Kamann S, Oppel E, Liu F, Reichl FX, Heinemann L, Högg C. Evaluation of Isobornyl Acrylate Content in Medical Devices for Diabetes Treatment. Diabetes Technol Ther. 2019;21(10):533-537. doi: 10.1089/dia.2019.0163. Epub 2019 Jul 9. PMID: 31287728.
- Voller LM, Warshaw EM. Acrylates: new sources and new allergens. Clin Exp Dermatol. 2020;45(3):277-283. doi: 10.1111/ced.14093. Epub 2019 Sep 30. PMID: 31565812
- Enberg J, Hamnerius N, Mowitz M. Allergic contact dermatitis caused by a new insulin pump system containing isobornyl acrylate. Contact Dermatitis. 2023;88(4):326-328. doi: 10.1111/cod.14274. PMID: 36607276.
- Uter W, Werfel T, Lepoittevin JP, White IR. Contact Allergy-Emerging Allergens and Public Health Impact. Int J Environ Res Public Health. 2020;17(7):2404. doi: 10.3390/ijerph17072404. PMID: 32244763; PMCID: PMC7177224.







