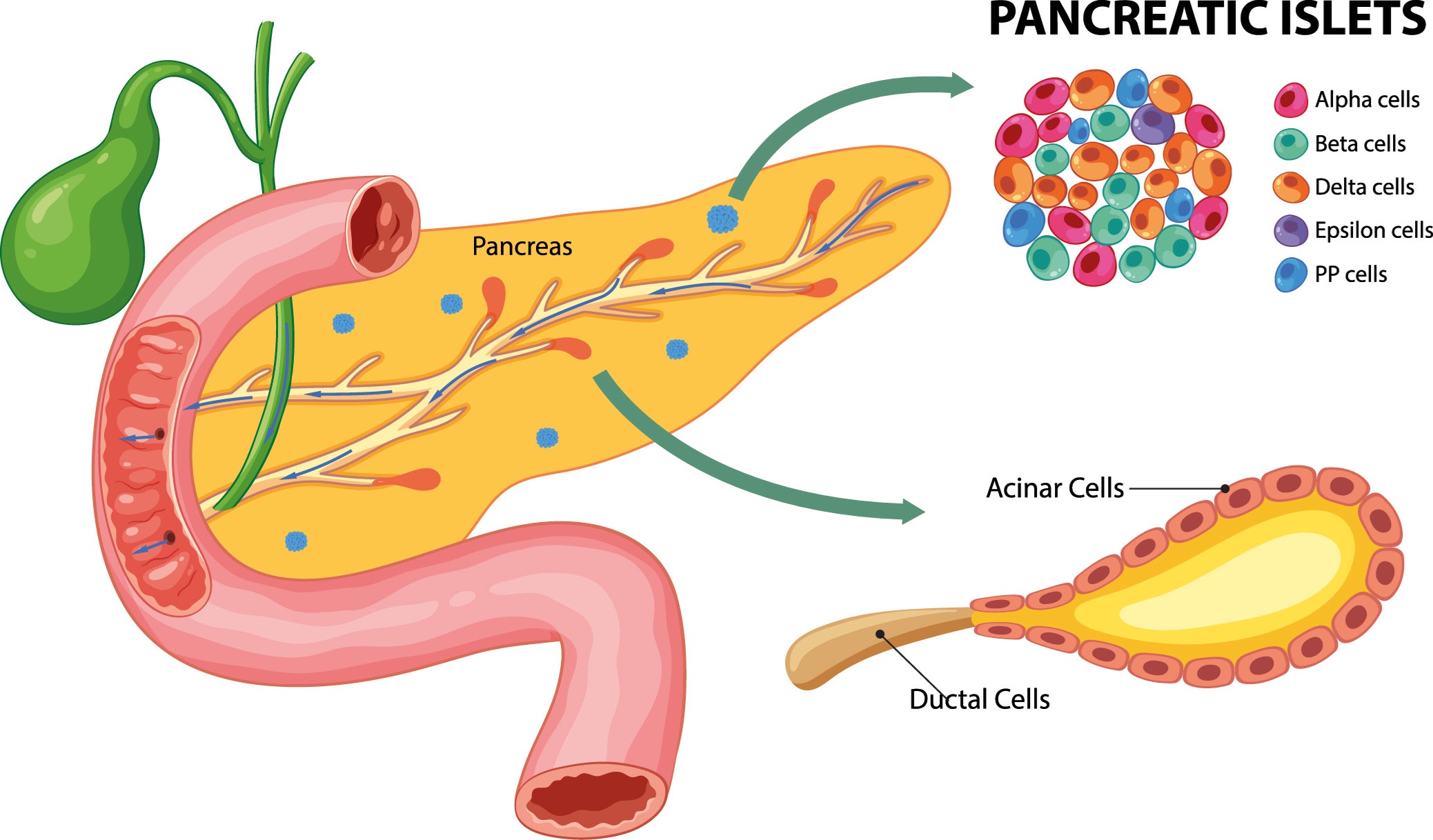
El glucagón es una de las principales hormonas en el control de la homeostasis de la glucosa en base a su efecto hiperglucémico, así como a su oposición a varias de las acciones de la insulina. En modelos animales de experimentación como el ratón, el islote de Langerhans está formado fundamentalmente por células beta pancreáticas, siendo el resto de tipos celulares alrededor de un 20% de la población total. Sin embargo, el islote humano se caracteriza por una mayor representación de las células alfa pancreáticas, que alcanza el 30-45% del total. Esta mayor proporción sugiere que las células alfa y la secreción de glucagón juegan un papel importante en la función del páncreas endocrino humano. Sin embargo, aun cuando el descubrimiento del glucagón tuvo lugar hace más de un siglo, el papel de este tipo celular en la diabetes ha permanecido desconocido durante décadas.
De hecho, si se realiza una búsqueda en una base de datos como PubMed acerca de los trabajos publicados sobre la célula alfa y su implicación en esta patología, éstos representan una proporción minoritaria respecto a los existentes sobre la célula beta pancreática. Independientemente del papel central que la insulina juega en la etiología de la diabetes, varios factores han jugado en contra de un conocimiento más profundo de las células secretoras de glucagón. Entre otros, la menor proporción de estas células en los modelos animales habituales en experimentación, las dificultades para aislar y purificar este tipo celular, así como limitaciones técnicas para identificar sus patrones funcionales han sido factores clave que han limitado la investigación de las células alfa.
En las dos últimas décadas, en cambio, el creciente desarrollo en biocomputación, en técnicas moleculares, genéticas y ómicas, así como el acceso a muestras pancreáticas e islotes humanos ha permitido un avance sin precedentes en el conocimiento de la célula alfa tanto en condiciones fisiológicas como en patologías como la diabetes y la obesidad. La consideración del rol de la célula alfa en la diabetes ha ido cambiando a la luz de los nuevos hallazgos. Frente a una visión más “insulinocéntrica” de la diabetes, Unger y Orci propusieron en los años setenta la hipótesis bihormonal de la diabetes, apoyada por sus excelentes trabajos en el campo y, posteriormente, postularon una perspectiva “glucagonocéntrica”. Actualmente, está ampliamente aceptado que las alteraciones de la célula alfa y el glucagón participan en la fisiopatología de la diabetes. De hecho, todos estos avances recientes están reconfigurando el papel de estas células, estableciendo nuevas perspectivas e impulsando nuevas líneas de investigación y desarrollo terapéutico. En este sentido, además de la liberación de glucagón, las células alfa pueden secretar incretinas como GLP-1, favoreciendo la secreción de insulina desde células beta próximas. Por otro lado, se están explorando las facultades específicas de las células alfa en proliferación, en supervivencia y en plasticidad como estrategia de regeneración de la masa de célula beta. Estos avances también están llevando al diseño de nuevos fármacos, o a la reevaluación de otros existentes, dirigidos a mitigar los efectos de la alteración de la función de las células alfa y/o de la acción del glucagón en diabetes.
ACTUALMENTE, ESTÁ AMPLIAMENTE ACEPTADO QUE LAS ALTERACIONES DE LA CÉLULA ALFA Y EL GLUCAGÓN PARTICIPAN EN LA FISIOPATOLOGÍA DE LA DIABETES
Función de la célula alfa pancreática: al igual que las células beta pancreáticas, las células secretoras de glucagón actúan como sensores de la glucosa plasmática. Los cambios producidos en los niveles de glucosa extracelular son eficientemente detectados por estas células y se trasladan de manera precisa a una secreción hormonal controlada. Este proceso implica la entrada de la glucosa a través de transportadores específicos de membrana, su metabolismo y la generación de señales metabólicas que regulan la actividad eléctrica y las señales de calcio intracelular, segundo mensajero que estimula el proceso de transporte y fusión de los gránulos de secreción a la membrana para liberar la insulina desde las células beta o el glucagón desde las células alfa.
Sin embargo, la existencia de diferencias específicas entre ambos tipos celulares a varios niveles como el transporte y el metabolismo de la glucosa, la expresión de canales iónicos, así como otras características bioquímicas y fisiológicas, permiten que la liberación de insulina y glucagón ocurra a concentraciones de glucosa diferentes. De esta manera, mientras que la hiperglucemia estimula la liberación de insulina, la secreción de glucagón se favorece en bajas concentraciones de glucosa, estableciendo así una de las principales defensas contra la hipoglucemia. No obstante, las células alfa también responden a otros nutrientes como aminoácidos y ácidos grasos, normalmente aumentando la secreción de glucagón, por lo que la regulación de estas células tras una ingesta dietética es compleja. Además, existen otros niveles de modulación de la actividad de las células alfa como la comunicación paracrina de las células beta y delta, las señales establecidas por incretinas y adipocinas así como el control procedente del sistema nervioso. Este complejo sistema de regulación de la célula alfa puede verse afectado en condiciones patológicas o contribuir a algunos de los síntomas de la diabetes, como se comenta en las siguientes secciones.
Acciones del glucagón: la acción más conocida y estudiada de esta hormona es la estimulación hepática de la gluconeogénesis y la glucogenólisis, aumentando así la producción y liberación hepática de glucosa al torrente sanguíneo. Este efecto está mediado principalmente por la acción del glucagón sobre la expresión y/o actividad de diferentes enzimas que participan en el metabolismo hepático de la glucosa. El glucagón regula también el metabolismo lipídico en hígado y, recientemente, se ha demostrado la existencia de un eje de comunicación hígado-célula alfa que participa en el metabolismo de los aminoácidos y sus niveles plasmáticos.
Las acciones del glucagón van más allá de la regulación de estos nutrientes; se ha demostrado que esta hormona puede modular diversos procesos metabólicos de interés farmacológico como la estimulación de la secreción de insulina, el control de la ingesta o la termogénesis. Existen numerosas evidencias preclínicas y clínicas mostrando que las acciones del glucagón están alteradas en condiciones patológicas como la diabetes, la obesidad y la esteatosis hepática.
Glucagón y diabetes: diversos estudios indican que los pacientes con diabetes presentan hiperglucagonemia, ya sea absoluta o relativa a la insulina, favoreciendo así una mayor liberación hepática de glucosa y contribuyendo a la hiperglucemia. Existen también alteraciones funcionales; entre ellas destaca que las células alfa no responden adecuadamente ante una disminución de glucosa en sangre, aumentando el riesgo de hipoglucemias, especialmente en pacientes con diabetes tipo 1 y en fases avanzadas de diabetes tipo 2. Igualmente, la supresión de la secreción de glucagón a altas concentraciones de glucosa es inadecuada, contribuyendo a hiperglucemia postprandial. Si bien muchas de estas alteraciones se conocían desde hace décadas, en los últimos años se han esclarecido muchos de los procesos y rutas de señalización implicadas en estas disfunciones.
Procesos y mecanismos en la disfunción de las células alfa en diabetes: existen importantes diferencias en la dinámica de la masa y función de las células alfa y beta pancreáticas durante la historia natural de la diabetes, tanto en tipo 1 como tipo 2. Si bien la masa de célula beta disminuye considerablemente durante la diabetes autoinmune, y decrece en etapas tardías de diabetes tipo 2, la masa de célula alfa en ambos tipos de diabetes permanece relativamente bien conservada respecto a las células beta, o al menos durante un tiempo mayor, dando lugar a una razón alfa/beta aumentada. Estas alteraciones podrían estar contribuyendo, en parte, a los mayores niveles plasmáticos de glucagón. La mayor prevalencia de las células alfa respecto a las células beta en diabetes puede estar asociada a su mayor capacidad de supervivencia frente a estímulos proapoptóticos propios del ambiente diabetogénico, en base a la expresión de ciertos genes y activación de rutas de señalización específicas de este tipo celular. Igualmente, se han demostrado que algunas células alfa tienen una mayor capacidad proliferativa, pudiendo así contribuir al mantenimiento de esta población celular.
Las alteraciones funcionales de la célula alfa en diabetes se han atribuido a varios factores, desde el deterioro de la comunicación con el sistema nervioso y con las señales paracrinas procedentes de la célula beta, hasta fallos intrínsecos de las células alfa asociados a la pérdida de sensibilidad a la glucosa y metabolismo de la misma. Las técnicas ómicas y análisis masivo de datos de células alfa purificadas a partir de modelos animales y de pacientes diabéticos está permitiendo profundizar en las bases moleculares de la disfunción de la célula alfa. En este sentido, la regulación genética y epigenética específica de las células alfa tiene un papel importante no sólo en la determinación de este tipo celular durante el desarrollo desde los progenitores pancreáticos, sino que también permite, entre otros atributos, que las células alfa en adultos presenten una gran plasticidad a efectos de identidad celular. De hecho, se ha propuesto que la diabetes tipo 2 implica un proceso de desdiferenciación de la célula beta y que podría involucrar también cambios de identidad celular hacia células productoras de glucagón. En esta línea, se ha observado la existencia de células que expresan insulina y glucagón en páncreas de pacientes con diabetes tipo 1 y 2. Se ha postulado que la presencia de estas células bihormonales podría ser indicio de cambios de identidad celular en condiciones diabetogénicas. Por otro lado, estudios recientes combinando análisis transcriptómicos y funcionales han sustentado la noción de que la disfunción de la célula alfa en diabetes podría deberse a la pérdida de madurez fenotípica, ya que se han encontrado cambios importantes en genes asociados a factores de transcripción y rutas de señalización que regulan tanto la identidad de la célula alfa como la secreción de glucagón. También se ha propuesto que la alteración del eje de comunicación hígado-célula alfa que regula el metabolismo y los niveles plasmáticos de los aminoácidos podría contribuir a algunas de las manifestaciones clínicas de la diabetes. Algunos estudios preclínicos recientes han demostrado que este eje puede ser interesante para el desarrollo farmacológico.
SE HA OBSERVADO LA EXISTENCIA DE CÉLULAS BIHORMONALES QUE EXPRESAN INSULINA Y GLUCAGÓN EN PÁNCREAS DE PACIENTES CON DIABETES TIPO 1 Y 2
Estrategias terapéuticas basadas en la célula alfa pancreática y la acción del glucagón: son muchos los trabajos que avalan que la disminución de la secreción o la acción del glucagón son estrategias beneficiosas en el contexto de la hiperglucagonemia y la terapia de la diabetes. Diferentes fármacos como los miméticos de GLP-1 o las sulfonilureas pueden inhibir la secreción de glucagón. Por otro lado, el antagonismo del receptor de glucagón se ha mostrado efectivo en modelos preclínicos de diabetes para bloquear los efectos de la excesiva señalización hepática de la hormona y, de esta manera, disminuir la hiperglucemia. Algunos de estos antagonistas se encuentran en fase clínica, aunque, debido a algunos efectos no deseados, se requiere aún más investigación para refinar estos fármacos antes de su aprobación clínica.
En base a los efectos metabólicos positivos resultantes de la activación suprafisiológica del receptor de glucagón induciendo termogénesis y gasto energético, así como inhibición de la ingesta, también se ha explorado el papel terapéutico de dobles y triples agonistas con actividad en los receptores de glucagón, GLP-1 y/o GIP. En base a esta combinación, los efectos hiperglucémicos resultantes de la activación del receptor de glucagón quedarían atenuados por los efectos generados por los receptores de ambas incretinas. Los resultados obtenidos tanto en modelos preclínicos como en la clínica son prometedores para la terapia de la obesidad, diabetes tipo 2 y enfermedad hepática.
SE ESTÁ INVESTIGANDO EL PAPEL TERAPÉUTICO DE DOBLES Y TRIPLES AGONISTAS CON ACTIVIDAD EN LOS RECEPTORES DE GLUCAGÓN, GLP-1 Y/O GIP
La célula alfa también podría constituir un reservorio para la regeneración de las células beta en pacientes diabéticos. Tal como se ha comentado anteriormente, la célula alfa posee una gran plasticidad, de manera que, en determinadas condiciones experimentales o mediante el tratamiento con agentes farmacológicos que incrementan la actividad de GLP-1, se puede inducir una transdiferenciación de célula alfa a célula beta. Existe un gran interés en conocer los mecanismos asociados a esta reprogramación para establecer protocolos eficientes que puedan inducir estos procesos.
https://www.linkedin.com/in/ivan-quesada-a4528b47?
Conclusiones
La disfunción de la célula alfa en diabetes y su contribución a la enfermedad está ampliamente aceptado. Estas alteraciones pueden contribuir a parte de la sintomatología de estos pacientes, especialmente a la hiperglucemia. De hecho, existe un gran interés farmacológico en modular la secreción y/o la acción del glucagón como herramienta terapéutica. Los recientes hallazgos, principalmente con la ayuda de los avances en técnicas moleculares, están permitiendo definir de manera detallada los procesos y mecanismos que determinan la implicación de la célula alfa en la fisiopatología de la diabetes. Todo ello permitirá mejorar las estrategias terapéuticas tanto en su dimensión farmacológica como en la optimización de protocolos enfocados a la regeneración de la célula beta pancreática.
Referencias
- Capozzi ME, D’Alessio DA, Campbell JE. The past, present, and future physiology and pharmacology of glucagon. Cell Metab. 2022; 34:1654-1674.
- Dai XQ, Camunas-Soler J, Briant LJB, Dos Santos T, Spigelman AF, et al. Heterogenous impairment of alpha cell function in type 2 diabetes is linked to cell maturation state. Cell Metab. 2022; 34:256-268.
- Furuyama K, Chera S, van Gurp L, Oropeza D, Ghila L, et al. Diabetes relief in mice by glucose-sensing insulin-secreting human α-cells. Nature 2019; 567:43-48.
- Knudsen JG, Hamilton A, Ramracheya R, Tarasov AI, Brereton M, et al. Dysregulation of Glucagon Secretion by Hyperglycemia-Induced Sodium-Dependent Reduction of ATP Production. Cell Metab. 2019; 29:430-442.
- Pettway YD, Saunders DC, Brissova M. The human α cell in health and disease. J Endocrinol. 2023; 258:e220298.
- Richter MM, Galsgaard KD, Elmelund E, Knop FK, Suppli MP, et al. The Liver-alpha-Cell Axis in Health and in Disease. Diabetes 2022; 71:1852-1861.
- Unger RH, Cherrington AD. Glucagonocentric restructuring of diabetes: a pathophysiologic and therapeutic makeover. J Clin Invest. 2012; 122:4-12.
- Walker JT, Saunders DC, Brissova M, Powers AC. The Human Islet: Mini-Organ With Mega-Impact. Endocr Rev. 2021; 42:605-657.
- Wang MY, Dean ED, Quittner-Strom E, Zhu Y, Chowdhury KH, et al. Glucagon blockade restores functional beta-cell mass in type 1 diabetic mice and enhances function of human islets. Proc Natl Acad Sci USA 2021; 118:e2022142118.
- Zhang Q, Ramracheya R, Lahmann C, Tarasov A, Bengtsson M, et al. Role of KATP channels in glucose-regulated glucagon secretion and impaired counterregulation in type 2 diabetes. Cell Metab. 2013; 18:871-82.