El desarrollo de órganos en miniatura en el laboratorio puede sonar a ciencia ficción. Sin embargo, gracias a los avances en la tecnología de las células madre y la bioingeniería, los científicos pueden ahora cultivar artificialmente una masa de células para crear organoides.
¿QUE SON LOS ORGANOIDES?
Si nos fijamos en la etimología de la palabra organoide, vemos que contiene el sufijo «-oide» que indica «semejante, con forma de». Por lo tanto, los organoides se asemejan a órganos en miniatura que crecen in vitro. Más concretamente, los organoides son cultivos celulares tridimensionales (3D) que incorporan algunas de las características clave, del órgano representado. Estos sistemas de cultivo in vitro contienen una población de células madre autorrenovables que se diferencian en múltiples tipos de células específicas del órgano representado, que exhiben una organización espacial (anatómica) similar a la del órgano correspondiente y son capaces de recapitular algunas funciones de ese órgano proporcionando un sistema fisiológicamente similar al del órgano del que derivan.
CABE DESTACAR QUE LOS ORGANOIDES DERIVADOS DE CÉLULAS PROGENITORAS ADULTAS, A PESAR DE TRATARSE DE CULTIVOS PRIMARIOS, TIENEN UNA CAPACIDAD ILIMITADA DE CRECIMIENTO, ASÍ COMO LA CAPACIDAD DE PODER SER CONGELADOS
¿DE DONDE PROVIENEN Y COMO CRECEN LOS ORGANOIDES?
Los organoides derivan de células progenitoras adultas de un tejido, o de células madre embrionarias o células madre pluripotentes inducidas. Los organoides crecen mayoritariamente en matrices 3D, como matrigel, aunque hay algunos tipos de organoides que crecen en suspensión, como los organoides neuronales o con un sistema llamado interfaz aire-líquido, como en el caso de organoides de riñón (Rossi et al., 2018).
Para el correcto crecimiento de los organoides el medio de cultivo en el que crecen debe ser suplementado con factores de crecimiento y citoquinas que imitan a las señales que reciben los progenitores embrionarios durante el desarrollo específico de cada tejido.
Además, se pueden generar organoides a partir de células tumorales de pacientes obtenidas de biopsias o resecciones de tumores. Los organoides tumorales están siendo de gran ayuda para realizar el cribado de distintos fármacos para realizar terapias dirigidas a cada paciente, es decir, medicina personalizada.
Cabe destacar que los organoides derivados de células progenitoras adultas, a pesar de tratarse de cultivos primarios, tienen una capacidad ilimitada de crecimiento, así como la capacidad de poder ser congelados. Esta característica permite poder hacer análisis de una misma muestra a lo largo del tiempo y analizar nuevas terapias años después de la obtención de la muestra.
¿QUE VENTAJAS PRESENTAN LOS CULTIVOS DE ORGANOIDES VERSUS LOS CULTIVOS CÉLULARES EN DOS DIMENSIONES?
Tras observar que las células en cultivos en dos dimensiones (2D) no presentan las mismas características que las células de los tejidos in vivo, los cultivos de organoides en 3D se han posicionado como sistemas modelo prometedores para estudiar el desarrollo tisular y diseñar nuevas terapias. Con los recientes hallazgos tecnológicos, los modelos de cultivo en 3D han acabado por ser una aproximación más pertinente del entorno in vivo de las células de los tejidos desde un punto de vista fisiológico. Ahora, para mejorar los cultivos de organoides ya existentes, los investigadores de los ámbitos de las ciencias físicas y de la ingeniería pretenden mejorar las condiciones de cultivo en 3D para desarrollar órganos en miniatura en una placa que permitan cultivar distintos tipos celulares juntos para representar la heterogeneidad celular de un tejido (células epiteliales, células mesenquimales, células inmunitarias…) y así también simular el nicho específico de cada tejido, así como las características dinámicas de estos, como por ejemplo fluido de líquidos.
LOS ORGANOIDES SON CADA VEZ MÁS COMPLEJOS A MEDIDA QUE LOS CIENTÍFICOS EMPIEZAN A INVESTIGAR MÁS PROFUNDAMENTE LOS MECANISMOS QUE RIGEN EL LINAJE DE LAS CÉLULAS PROGENITORAS Y LA DIFERENCIACIÓN
Los organoides son cada vez más complejos a medida que los científicos empiezan a investigar más profundamente los mecanismos que rigen el linaje de las células progenitoras y la diferenciación. Se han cultivado modelos de organoides de muchos órganos, como el cerebro, el hígado, los riñones, el pecho, la retina y órganos del tracto gastrointestinal, incluido el páncreas. Estos pueden utilizarse como modelos de infección de patógenos y de detección de toxicidad, así como para probar moléculas farmacéuticas, la medicina personalizada y la medicina regenerativa o el trasplante de órganos.
ORGANOIDES PANCREATICOS COMO FUENTE DE CÉLULAS PRODUCTORAS DE INSULINA: UNA PROMESA AÚN NO CUMPLIDA
En 2013 se publicó el primer artículo que demostró que a partir de células ductales pancreáticas se podían generar organoides pancreáticos (Huch et al. 2013), indicando que estas células tenían cierta capacidad progenitora in vitro, ya que las únicas células que son capaces de formar organoides derivados de tejido son las células progenitoras adultas residentes en los tejidos. Por lo tanto, ya en 2013 se postuló que los organoides pancreáticos podrían representar una fuente ilimitada de células productoras de insulina, para el desarrollo de terapias celulares de reemplazo en personas con diabetes.
La eficiencia de diferenciación de los organoides pancreáticos a células productoras de insulina es muy baja, entre 0.5%-5% en los primeros trabajos científicos (revisado en Casamitjana et al., 2022). La única manera de incrementar esta eficiencia de manera significativa es la sobreexpresión de factores que sabemos que son importantes para la formación de células productoras de insulina (Neurogenina3, Pdx1 y MafA), llegando a un 22% de eficiencia de diferenciación (revisado en Casamitjana et al., 2022).
Varias razones podrían explicar la limitada capacidad de diferenciación endocrina de los organoides:
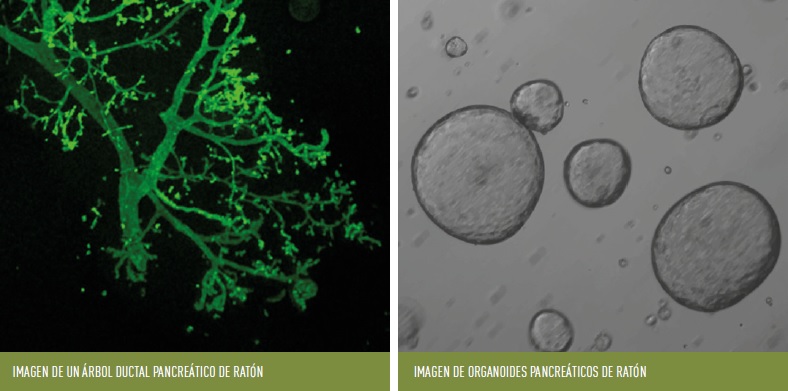
En primer lugar, la baja capacidad regenerativa del tejido pancreático adulto sugiere que, si existe un progenitor residente, debería ser de muy baja abundancia. Por lo tanto, no todas las células ductales pueden tener capacidad progenitora ni mostrar una capacidad de formación de organoides similar. Por lo tanto, una mejor comprensión de la heterogeneidad ductal podría resaltar las subpoblaciones ductales a estudiar en cultivos de organoides y evaluar su capacidad de diferenciación endocrina.
En segundo lugar, los organoides podrían tener una capacidad de diferenciación endocrina limitada debido a características epigenéticas. Una mejor comprensión de las diferencias entre los progenitores embrionarios y los organoides puede identificar un freno epigenético que debe modularse para una diferenciación endocrina adecuada.
En tercer lugar, los componentes de la matriz extracelular (ECM) podrían ser cruciales in vitro, como lo son in vivo, para la morfogénesis y diferenciación adecuadas de los linajes pancreáticos. Los sistemas de crecimiento de organoides actuales se basan principalmente en señales bioquímicas intrínsecas o extrínsecas (es decir, factores de crecimiento) e interacciones célula-célula para controlar el destino de las células madre, pero hay elementos importantes a considerar que incluyen la ECM y las señales biofísicas que aún se desconocen. Esto se debe a que los modelos in vitro actuales se basan en una matriz comercial llamada Matrigel, de origen animal que contiene laminina, colágeno IV, entactina, sulfato de heparán y factores de crecimiento (Rezakhani et al., 2021) en proporciones que son difíciles de manipular y son variables. Una matriz controlada en lugar de Matrigel estándar podría ser clave para la diferenciación de organoides a célula β.
En nuestro laboratorio estamos abordando estas limitaciones. En primer lugar, hemos analizado los genes expresados en más de 20.000 células ductales pancreáticas de ratón, a nivel de célula única, y estamos actualmente analizando estas células en muestras humanas en colaboración con el laboratorio del Dr. Eduard Montanya (Jefe de grupo de Diabetes, Nutrición y Enfermedades Endocrinas en IDIBELL), de esta manera hemos descubierto poblaciones ductales hasta ahora desconocidas con distintas capacidades de formación de organoides y diferenciación endocrina. Ahora estamos también investigando si hay factores epigenéticos que limitan la diferenciación de los organoides a células endocrinas para modularlos de manera que incrementemos la eficiencia de diferenciación de estos.
En resumen, un mejor conocimiento de los aspectos mencionados nos ayudará a desarrollar eficientemente células productoras de insulina a partir de organoides pancreáticos derivados de células ductales del mismo paciente y en un futuro, de momento lejano, podamos usar estos organoides para generar células productoras de insulina. La ventaja de esta terapia celular de reemplazamiento versus la diferenciación de células productoras de insulina a partir de células madre embrionarias o células pluripotentes inducidas son, en primer lugar, que los organoides se podrían derivar de tejido pancreático del propio paciente. En segundo lugar, que no se trata de células madre pluripotentes, por lo tanto, no hay riesgo de formación de tumores derivados de estos. En tercer lugar, que ya partimos de progenitores pancreáticos por lo tanto la diferenciación a célula productora de insulina debería ser más rápida. En cuarto lugar, los organoides pueden expandirse indefinidamente y congelarse, de manera que siempre se puede volver a la muestra de origen si fuera necesario.
Referencias
- Rossi et al., Nature Review Genetics, 2018
- Huch et al., EMBO Journal, 2013
- Casamitjana et al., Frontiers in Cell and Developmental Biology, 2022
- Rezakhani et al., Biomaterial, 2021