La diabetes tipo 1 es una enfermedad compleja en la que la predisposición genética desempeña un papel importante y cuyo desarrollo comienza antes de que se manifiesten síntomas o se realice el diagnóstico clínico. Su progresión se divide en dos fases preclínicas (fase 1 y 2), y la fase clínica (fase 3). Aunque estas fases están basadas en parámetros clínicos, a continuación, se explican sus características principales y su posible relación con la presencia de células del sistema inmune (infiltración linfocitaria) en el páncreas. La infiltración de células inmunitarias en los islotes pancreáticos provoca una inflamación crónica conocida como insulitis.
La fase 1 se identifica por la presencia de dos o más anticuerpos específicos contra proteínas de las células beta del páncreas, llamados autoanticuerpos. Su detección indica que el sistema inmunitario ha empezado a reconocer las células beta como extrañas, un proceso conocido como autoinmunidad. En esta fase es posible encontrar células inmunitarias en los islotes pancreáticos, aunque los niveles de glucosa en sangre permanecen normales y no se manifiestan síntomas ya que la destrucción de las células beta aún no es significativa.
En la fase 2 el número de células inmunitarias aumenta, causando una inflamación crónica en los islotes que es conocida como insulitis. El ataque autoinmune progresa gradualmente, provocando una pérdida cada vez mayor de células beta. En esta fase comienzan a observarse islotes que han perdido completamente sus células beta. Esta disminución en el número de células productoras de insulina resulta en una regulación inadecuada del metabolismo de la glucosa, lo que conduce a niveles anormales de glucosa en sangre. Esto se conoce como disglucemia. A pesar de estos cambios, los síntomas aún no son evidentes. La duración de las fases 1 y 2 varía considerablemente, desde unos pocos meses hasta varios años, y tiende a ser más corta en niños, en los que la diabetes tipo 1 tiende a manifestarse de forma más agresiva.
La fase 3 está marcada por la aparición de los síntomas clínicos y el diagnóstico de la enfermedad. En esta fase la pérdida significativa de células beta ya no puede compensarse, lo que provoca un aumento de los niveles de glucosa en sangre (hiperglucemia) y la manifestación de síntomas característicos como sed excesiva, necesidad frecuente de orinar, fatiga y pérdida de peso. En el páncreas, la infiltración de células inmunitarias se intensifica, afectando a un número creciente de islotes donde se puede observar una pérdida total de células beta. No obstante, en el momento del diagnóstico, muchas personas aún conservan una cantidad considerable de células beta, aunque esta cantidad varía significativamente de un individuo a otro.
EN EL MOMENTO DEL DIAGNÓSTICO DE LA DIABETES TIPO 1, MUCHAS PERSONAS AÚN CONSERVAN UNA CANTIDAD CONSIDERABLE DE CÉLULAS BETA EN LOS ISLOTES
La predisposición genética
La diabetes tipo 1 está asociada a una predisposición genética, donde los genes relacionados con el antígeno leucocitario humano (HLA, por sus siglas en inglés) contribuyen aproximadamente entre el 30 y el 50% del riesgo genético de desarrollar la enfermedad. En particular, los alelos HLA-DR3-DQ2 y HLA-DR4-DQ8 están asociados con un mayor riesgo, y este riesgo es aún mayor en personas que presentan ambos alelos (heterocigosis DR3/4).
El riesgo genético restante se atribuye a aproximadamente 50 genes adicionales no relacionados con el HLA, entre ellos, genes que codifican para la insulina y otros implicados en la regulación del sistema inmunitario y en la función de las células beta. Además, la variación genética puede influir en la respuesta a factores ambientales, determinando así la susceptibilidad inicial y la progresión de la enfermedad.
Aunque la predisposición genética es necesaria para el desarrollo de la diabetes tipo 1, no basta por sí sola para desencadenar la enfermedad. Los factores ambientales también desempeñan un papel crucial en su patogénesis. Aspectos como el entorno materno e intrauterino, el tipo de parto neonatal, infecciones virales, el microbioma, el uso de antibióticos, ciertos alimentos y otros factores ambientales podrían actuar como desencadenantes, activando la respuesta autoinmune en individuos con predisposición genética.
Autoinmunidad e infiltración linfocitaria
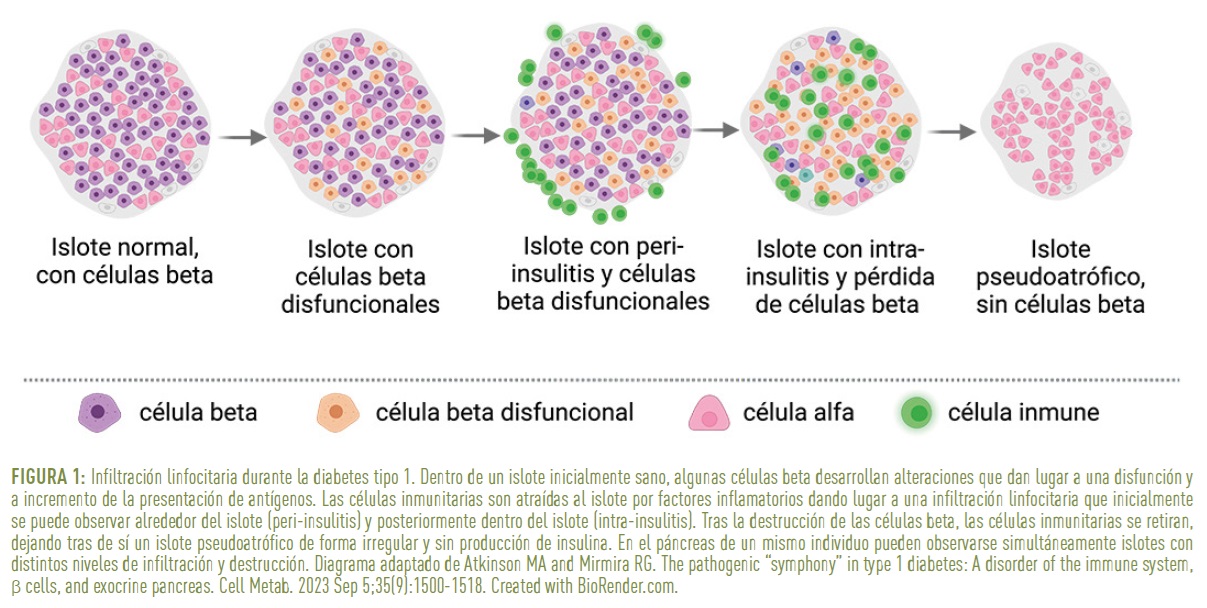
En la fase 1 de la diabetes tipo 1 el sistema inmunitario comienza a reconocer ciertas proteínas de las células beta como extrañas (figura 1). Este fenómeno es conocido como autoinmunidad y su causa exacta aún no se conoce del todo. Durante esta fase la respuesta inmune se dirige contra los autoantígenos: proteínas intracelulares que se presentan en la superficie de las células beta a través de moléculas del HLA de clase I (HLA-I). Aunque en esta fase la infiltración de los islotes no es muy evidente, podemos encontrar diversos tipos celulares:
Los linfocitos B producen autoanticuerpos dirigidos contra las células beta, que se unen a los autoantígenos y forman complejos inmunes que contribuyen a la inflamación y la destrucción celular. Los cinco autoanticuerpos identificados hasta hoy y utilizados como biomarcadores para detección de la diabetes tipo 1 son: (a) anticuerpos anti-islotes pancreáticos (ICA), (b) anticuerpos anti-insulina (IAA), (c) anticuerpos contra la isoforma 65 kDa de la descarboxilasa del ácido glutámico (GADA), (d) anticuerpos anti-tirosina fosfatasa (IA-2A), y (e) anticuerpos contra el transportador de ZnT8 (ZnT8A). Los linfocitos B también son células presentadoras de antígeno que pueden englobar pequeños fragmentos de las proteínas, procesarlos intracelularmente y expresarlos unidos a moléculas del HLA de Clase II (HLA-II) en la superficie del linfocito B. Estos antígenos pueden ser reconocidos por linfocitos T, iniciando una respuesta inmune celular.
Las células dendríticas y los macrófagos también infiltran los islotes pancreáticos donde actúan como células presentadoras de antígenos (CPAs). A diferencia de los linfocitos B cuyo papel principal es producir anticuerpos, las CPAs son células especializadas en capturar, procesar y presentar fragmentos de proteínas a otras células del sistema inmune. En la diabetes tipo 1, las CPAs presentan antígenos de las células beta a los linfocitos T en los ganglios linfáticos cercanos, activándolos. Los linfocitos T citotóxicos (CD8+) migran desde los ganglios linfáticos al páncreas, donde reconocen los autoantígenos y destruyen las células beta por contacto directo, liberando sustancias tóxicas o proteínas específicas como perforina y granzima. Los linfocitos T colaboradores (CD4+) coordinan la respuesta inmune al liberar citoquinas inflamatorias, proteínas encargadas de regular la respuesta inmune y de reclutar y activar otras células inmunitarias. Las citoquinas como interferón-gamma, interleucina-1 y factor de necrosis tumoral alfa no solo dañan las células beta, sino que también estimulan la producción de más citoquinas, creando un ciclo continuo de inflamación y destrucción celular. Cuando reconocen erróneamente las células beta del propio cuerpo, tanto los linfocitos T CD8+ como los CD4+ se conocen como linfocitos T autorreactivos.
A medida que progresa la diabetes tipo 1, aumenta la proporción de islotes infiltrados y la cantidad de linfocitos T, extendiéndose por todo el páncreas (figura 1). Los linfocitos T citotóxicos (CD8+) son los glóbulos blancos más abundantes en los islotes infiltrados. El diagnóstico patológico de insulitis se basa en la detección de al menos tres islotes pancreáticos infiltrados por 15 o más células CD45+ por islote. El marcador CD45 está presente en todos los tipos de células inmunitarias, incluyendo linfocitos T, linfocitos B, monocitos y granulocitos. Si la infiltración ocurre alrededor de los islotes, se denomina peri-insulitis, mientras que, si ocurre dentro de los islotes, se llama intra-insulitis.
Estudios histopatológicos (de tejidos bajo el microscopio) en páncreas de donantes humanos han revelado que los individuos con múltiples autoanticuerpos antes del diagnóstico (fase 2) y aquellos diagnosticados recientemente (fase 3) presentan una gran heterogeneidad en la infiltración de los islotes. En el páncreas de un individuo se pueden observar islotes “sanos” sin infiltración linfocitaria coexistiendo con islotes con una infiltración intensa, así como con islotes pseudoatróficos en los que todas las células beta han sido destruidas y que generalmente ya no están infiltrados (figura 1). Las únicas células que persisten en estos islotes pseudoatróficos son los otros tipos de células endocrinas del islote: las células alfa, gamma, epsilon y del polipéptido pancreático (PP).

Comunicación entre las células beta y el sistema inmunitario
El proceso de destrucción de las células beta no se debe únicamente al sistema inmunitario. De hecho, se cree que las células beta desempeñan un papel activo. Diversas alteraciones en estas células preceden a la aparición de la enfermedad y pueden contribuir a la autoinmunidad. Un factor crucial en este proceso es el aumento en la expresión de antígenos a través de moléculas de HLA-I, un fenómeno conocido como hiperexpresión del HLA-I. Este aumento en la expresión potencia las interacciones entre HLA-I y los linfocitos T, facilitando la presentación de antígenos y promoviendo la activación de los linfocitos T CD8+ autorreactivos.
La hiperexpresión del HLA-I en los islotes pancreáticos se ha identificado como una característica distintiva de la diabetes tipo 1. Sin embargo, los factores que desencadenan esta hiperexpresión aún se desconocen. Una posible explicación es que, bajo condiciones de estrés, las células beta liberan citoquinas inflamatorias que inducen la hiperexpresión del HLA-I, no sólo en la célula afectada, sino también en las células adyacentes dentro del islote. Estas citoquinas podrían actuar como señales atrayendo células inmunitarias que dañan los islotes y promueven una mayor expresión del HLA-I en células que, de otro modo, no serían tan visibles para el sistema inmunitario.
Además, es posible que las células beta dañadas o en estado de estrés procesen y presenten antígenos celulares de manera anormal Esta alteración en el procesamiento podría además generar antígenos nuevos, conocidos como neoantígenos, que el sistema inmunitario reconoce como proteínas extrañas. La presentación de estos neoantígenos a través del HLA-I podría llevar a que los linfocitos T CD8+ autorreactivos destruyan las células beta.
EN LAS ÚLTIMAS DÉCADAS SE HAN DESARROLLADO DIVERSAS ESTRATEGIAS CON EL OBJETIVO DE PROTEGER LAS CÉLULAS BETA DEL ATAQUE AUTOINMUNE Y FRENAR O PREVENIR LA DIABETES TIPO 1 EN INDIVIDUOS DE RIESGO
¿Qué terapias existen para proteger las células beta en la diabetes tipo 1?
En las últimas décadas se han desarrollado diversas estrategias con el objetivo de proteger las células beta del ataque autoinmune y frenar o prevenir la diabetes tipo 1 en individuos de riesgo. Entre estas inmunoterapias destaca el anticuerpo Teplizumab, que se une a la proteína CD3 de la superficie de los linfocitos T, modulando su actividad sin suprimir completamente el sistema inmunitario. Comercializado en los Estados Unidos desde noviembre de 2022, es el primer fármaco aprobado para retrasar la aparición de la diabetes tipo 1 en adultos y niños mayores de 8 años en la fase 2 de la enfermedad. Los estudios clínicos han demostrado que un ciclo de tratamiento de 14 días con Teplizumab puede retrasar aproximadamente 2 años la progresión de la enfermedad a la fase 3 y ayudar a preservar la funcionalidad de las células beta restantes. Estudios adicionales también han demostrado que dos ciclos de 12 días pueden preservar la función de las células beta en niños y adolescentes con diabetes tipo 1 recién diagnosticada.

Asimismo, las terapias inmunes basadas en antígenos consisten en administrar proteínas específicas de las células beta para enseñar al sistema inmunitario a no reconocerlas como extrañas. Un ejemplo es el estudio “Primary Oral Insulin Trial” (POInT) en el que se utiliza insulina administrada por vía oral para inducir tolerancia inmunitaria a la insulina y evitar la destrucción de las células beta. A diferencia de la insulina inyectable, la insulina en polvo se administra diariamente junto con una comida y no afecta los niveles de glucosa en sangre.
La investigación actual también se enfoca en proteger las células beta mediante la detección temprana de la enfermedad. En Alemania, estudios como Fr1da buscan identificar a niños con alto riesgo de desarrollar diabetes tipo 1 mediante la detección de autoanticuerpos y así poder tratar la enfermedad de manera óptima desde el principio, previniendo desequilibrios metabólicos graves. Por otro lado, el estudio “Antiviral Action against Type 1 diabetes Autoimmunity» (AVAnT1A) explora la posible prevención del desarrollo de autoanticuerpos mediante la vacunación contra COVID-19 en bebés con alto riesgo genético. Este estudio se basa en observaciones durante la pandemia que indicaron que niños con mayor riesgo de diabetes tipo 1 tenían más probabilidades de desarrollar autoanticuerpos tras contraer una infección por SARS-CoV-2. En el estudio AVAnT1A también se monitorean muestras de saliva y heces para identificar los virus con los que los niños han estado en contacto con el objetivo de aclarar las conexiones entre las infecciones virales en la infancia temprana y la diabetes tipo 1. Por último, el estudio “European action for the Diagnosis of Early Non-clinical Type 1 diabetes For disease Interception» (EDENT1FI) tiene como objetivo la detección temprana de la enfermedad en 200.000 niños en toda Europa, además de evaluar el impacto psicosocial, médico y económico de esta detección en diversos sistemas de salud y poblaciones europeas. Esto permitirá el desarrollo de estrategias terapéuticas innovadoras y más personalizadas para la prevención y la gestión eficaz de la diabetes tipo 1.
Conclusiones
La predisposición genética, junto con diversos factores ambientales, desempeña un papel crucial en el desarrollo de la enfermedad. Se sabe que el ataque autoinmune ha comenzado tiempo antes del momento del diagnóstico clínico de la enfermedad, resultando en la pérdida de las células beta. Estas células son atacadas por el sistema inmunitario debido al reconocimiento anómalo de autoantígenos. Este reconocimiento erróneo desencadena una respuesta autoinmune que conduce a la infiltración de los islotes pancreáticos por diversas células inmunitarias. Entre estas células, los linfocitos B producen autoanticuerpos, los cuales amplifican la respuesta autoinmune y sirven como marcadores de la enfermedad detectables en sangre. Los linfocitos T citotóxicos (CD8+) destruyen las células beta, en tanto los linfocitos T colaboradores (CD4+) coordinan el ataque autoinmune y reclutan más células inmunitarias. Además, las células beta también juegan un papel activo en la progresión de la enfermedad al producir proteínas anormales y, al incrementar la expresión de las moléculas del HLA-I, aumentando la visibilidad de las células beta al sistema inmunitario. Los avances más recientes en la investigación se centran en la prevención durante las fases iniciales de la enfermedad mediante el uso de inmunomoduladores con el objetivo de evitar o frenar la progresión del ataque autoinmune y así preservar las células beta.
Este artículo ha sido revisado por un Asociado Certificado de INPACT. INPACT es INNODIA People living with Type 1 Diabetes Community (Comunidad de Personas con Diabetes Tipo 1 de INNODIA) y su programa de certificación garantiza que las perspectivas de las personas con experiencia vivida y su opinión experta son parte integral de los aspectos relevantes de la investigación y el desarrollo de medicamentos.
X: @Teresa_IDF1
Website Type 1 Diabetes Pathology Research Unit: https://www.helmholtz-munich.de/en/idf/research-area/type-1-diabetes-pathology
Website: https://www.helmholtz-munich.de/en/idf/pi/teresa-rodriguez-calvo
LinkedIn: www.linkedin.com/in/teresarodriguezcalvo
LinkedIn: www.linkedin.com/in/patricia-velado/
BIBLIOGRAFÍA
- Apaolaza, P. S., Balcacean, D., Zapardiel-Gonzalo, J., & Rodriguez-Calvo, T. (2023). The extent and magnitude of islet T cell infiltration as powerful tools to define the progression to type 1 diabetes. Diabetologia, 66(6), 1129-1141.
- Atkinson, M. A., & Mirmira, R. G. (2023). The pathogenic “symphony” in type 1 diabetes: A disorder of the immune system, β cells, and exocrine pancreas. Cell Metabolism.
- Bruggeman, Y., Martens, P. J., Sassi, G., Viaene, M., Wasserfall, C. H., Mathieu, C., & Gysemans, C. (2023). Footprint of pancreas infiltrating and circulating immune cells throughout type 1 diabetes development. Frontiers in Endocrinology, 14, 1275316
- GPPAD | Global Platform for the Prevention of Autoimmune Diabetes https://www.gppad.org/de-en/
- Insel, R. A., Dunne, J. L., Atkinson, M. A., Chiang, J. L., Dabelea, D., Gottlieb, P. A., … & Ziegler, A. G. (2015). Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes care, 38(10), 1964-1974.
- Jacobsen, L. M., Bocchino, L., Evans-Molina, C., DiMeglio, L., Goland, R., Wilson, D. M., … & Sosenko, J. M. (2020). The risk of progression to type 1 diabetes is highly variable in individuals with multiple autoantibodies following screening. Diabetologia, 63, 588-596.
- Richardson, S. J., Rodriguez-Calvo, T., Gerling, I. C., Mathews, C. E., Kaddis, J. S., Russell, M. A., … & Morgan, N. G. (2016). Islet cell hyperexpression of HLA class I antigens: a defining feature in type 1 diabetes. Diabetologia, 59(11), 2448-2458.
- Scherm, M. G., Wyatt, R. C., Serr, I., Anz, D., Richardson, S. J., & Daniel, C. (2022). Beta cell and immune cell interactions in autoimmune type 1 diabetes: How they meet and talk to each other. Molecular Metabolism, 64, 101565.
- Herold KC, Bundy BN, Long SA, Bluestone JA, DiMeglio LA, Dufort MJ, Gitelman SE, Gottlieb PA, Krischer JP, Linsley PS, Marks JB, Moore W, Moran A, Rodriguez H, Russell WE, Schatz D, Skyler JS, Tsalikian E, Wherrett DK, Ziegler AG, Greenbaum CJ; Type 1 Diabetes TrialNet Study Group. An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes. N Engl J Med. 2019 Aug 15;381(7):603-613. doi: 10.1056/NEJMoa1902226. Epub 2019 Jun 9. Erratum in: N Engl J Med. 2020 Feb 6;382(6):586.
- Ramos EL, Dayan CM, Chatenoud L, Sumnik Z, Simmons KM, Szypowska A, Gitelman SE, Knecht LA, Niemoeller E, Tian W, Herold KC; PROTECT Study Investigators. Teplizumab and β-Cell Function in Newly Diagnosed Type 1 Diabetes. N Engl J Med. 2023 Dec 7;389(23):2151-2161.