La variabilidad glucémica es uno de los problemas más complejos en el control glucémico de las personas con diabetes tipo 1 (DM1). Aunque el concepto de variabilidad fuese conocido desde hace décadas por el personal sanitario dedicado a la atención de la DM1 (se hablaba de personas con diabetes inestable’), no recibió la consideración merecida hasta la introducción de los sistemas de monitorización continua/flash de glucosa (MCG). La causa de este olvido era probablemente doble: por un lado, la escasa evidencia, hace años, de un claro impacto de la variabilidad glucémica sobre las complicaciones de la diabetes frente a la clara existencia de un nexo causal entre glucemia media, medida como HbA1c, y complicaciones microvasculares como retinopatía y nefropatía; por el otro, la complejidad del problema, tanto en su identificación, (que requería monitorización capilar con cierta frecuencia), como en la búsqueda de soluciones, lo cual fomentaba cierta inercia terapéutica (¿si la HbA1c es buena, por qué tengo que fijarme en la variabilidad? ¡Al fin y al cabo no hay evidencia de que sea útil atajarla!).
Sin embargo, la difusión de la MCG ha puesto de manifiesto la magnitud del problema, estimulando la investigación en ese campo: en los últimos años se ha acumulado evidencia científica de la asociación entre mayor variabilidad glucémica e hipoglucemia, desarrollo de complicaciones crónicas microvasculares y riesgo cardiovascular (1), haciendo imprescindible el abordaje de esta condición. Adicionalmente, es evidente cómo la dificultad en predecir la glucemia tiene un fuerte impacto tanto para el paciente como para el personal sanitario involucrado en su tratamiento. Para el paciente representa una posible fuente de riesgo (como mínimo, hiper e hipoglucemias indeseadas) y es causa de estrés psicológico (fundamentalmente derivado de la incertidumbre). Para los profesionales representa un problema difícil de abordar, que requiere tiempo, y por lo tanto una posible fuente de frustración en consultas habitualmente dotadas de poco tiempo.
Por todo ello surge la necesidad de identificar y clasificar la variabilidad glucémica y sus causas, y buscar soluciones para reducirla.
1. ¿Qué es la variabilidad glucémica? ¿Cuáles son sus causas?
Como decíamos antes, la variabilidad glucémica es un concepto que ha adquirido mucho protagonismo en el ámbito de la diabetes en los últimos años (2,3). En particular, a pesar de los métodos de ajuste de la dosis de insulina prandial (entre ellos, el recuento de hidratos de carbono de la ingesta) (4,5) y de los avances tecnológicos (6), la variabilidad glucémica en el período post-prandial (en las 3-6 horas sucesivas a la ingesta) es uno de los problemas más complejos en el control glucémico de los pacientes con DM1.
Pero, ¿qué es la variabilidad? Aunque pueda parecerlo, esta pregunta no es trivial. Hay muchísimas formas de medirla, según lo que queramos ver: cuánto fluctúa la glucemia en un día; la diferencia de la glucemia media entre días; la diferencia en el mismo período/hora (por ejemplo, al despertar) de días distintos; el riesgo de hiper o hipoglucemia, etc. Pero desde un punto de vista práctico, y por sus implicaciones en la clínica, se puede dividir en dos grandes grupos (figuras 1 y 2):
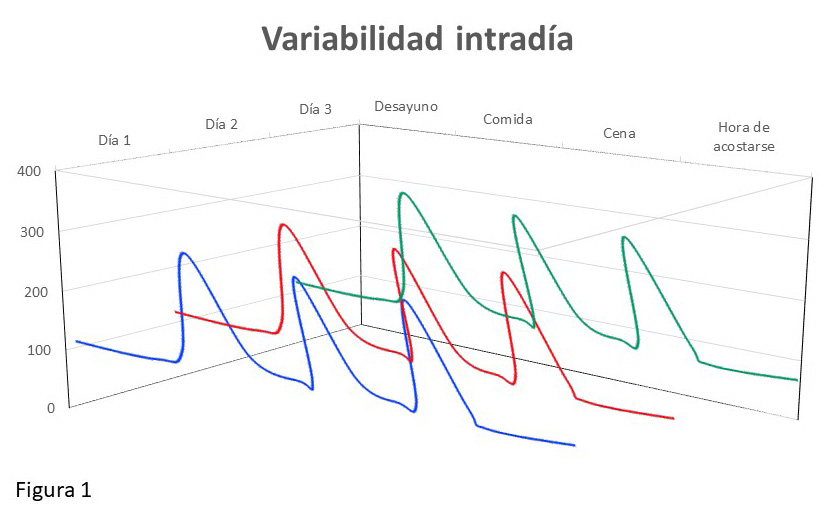
1. La variabilidad intra-día. Es decir, las variaciones de glucemia a lo largo del día.
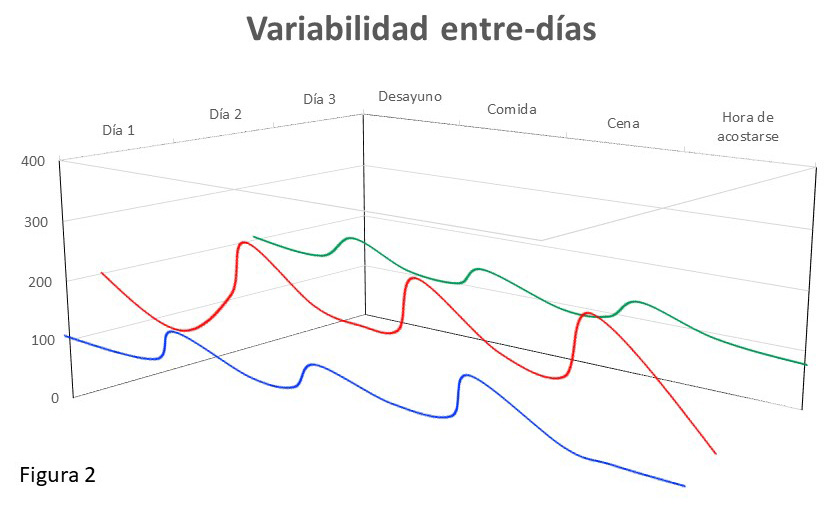
2. La variabilidad entre-días, que se entiende mejor como falta de reproducibilidad de las curvas glucémicas en días distintos.
Con respecto a la primera, nos referimos a las fluctuaciones que se producen a lo largo del día, debido por ejemplo a las comidas, al ejercicio físico, a la omisión de inyecciones de insulina, etc. Como vemos en el ejemplo de la figura 1, hay elevaciones significativas de la glucemia por encima del rango deseado (este último generalmente es 70-180 mg/dl), en respuesta a las comidas; sin embargo, este patrón se repite de forma prácticamente idéntica a lo largo de los 3 días representados. En otras palabras, no se consigue controlar bien la glucemia a lo largo del día (en el período post-prandial), pero el mismo fenómeno ocurre con poca variabilidad entre días (la glucemia en días distintos es muy similar). La solución en ese caso sería sencilla: dado que hay un claro patrón de hiperglucemia post-prandial, se debería actuar en la dosis/tipo de insulina rápida, y/o cantidad/tipo de carbohidratos (CHO).
Con respecto a la segunda, como se puede apreciar en la figura 2, nos referimos a la presencia de curvas glucémicas distintas en días diferentes. Esto puede ocurrir con una variabilidad intra-día baja: la glucemia fluctúa poco a lo largo del día, pero es muy distinta de un día a otro. Esto se puede deber a horarios de comida variables (por ejemplo, trabajos por turnos), a días con y otros sin realización de actividad deportiva, etc.
PARA LOS PROFESIONALES REPRESENTA UN PROBLEMA DIFÍCIL DE ABORDAR, QUE REQUIERE TIEMPO, Y POR LO TANTO UNA POSIBLE FUENTE DE FRUSTRACIÓN EN CONSULTAS HABITUALMENTE DOTADAS DE POCO TIEMPO
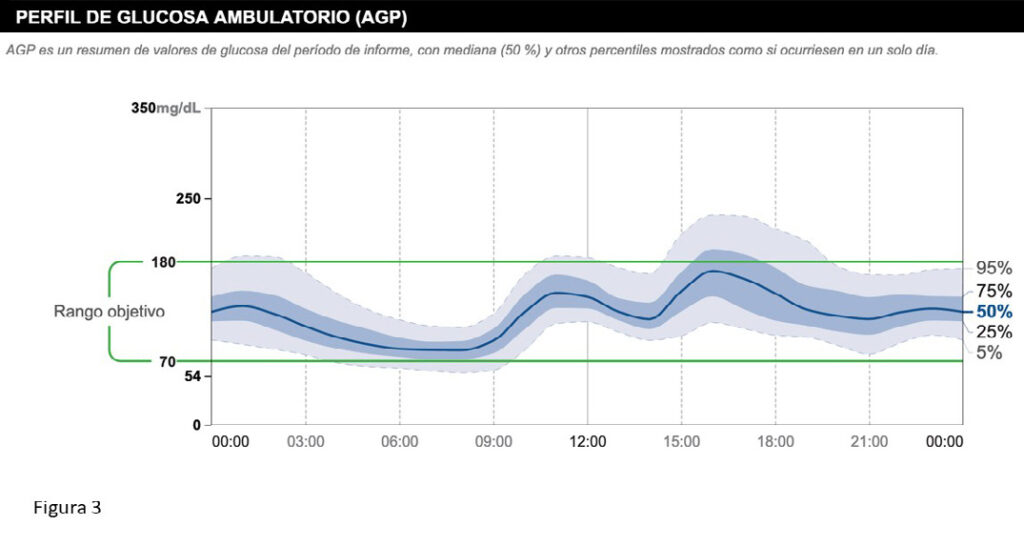
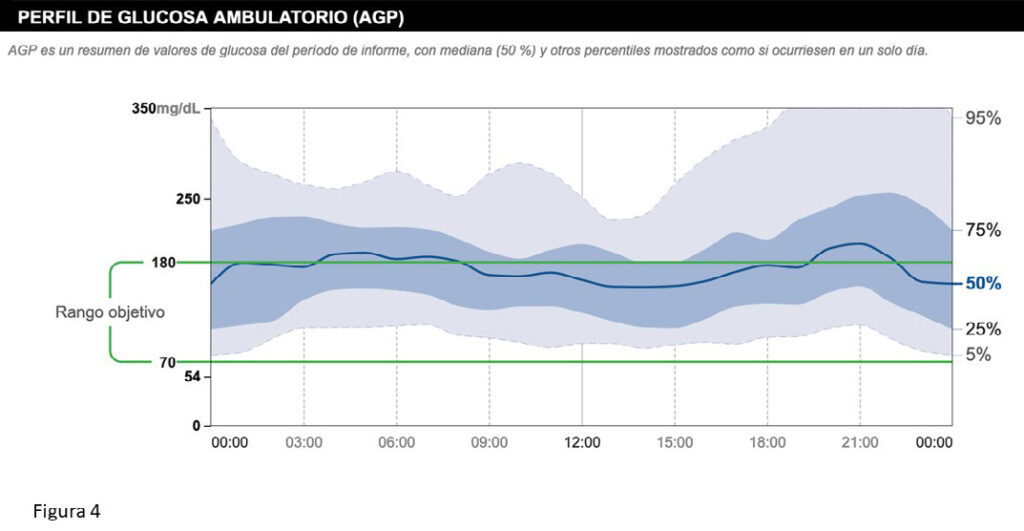
Aunque la diferenciación entre variabilidad intra-día y entre-días puede parecer artificiosa, y las causas, al menos en parte coincidir, resulta útil para entender que, cuando nos enfrentamos a la variabilidad glucémica, tenemos que intentar buscar patrones, es decir comportamientos similares de la glucemia que se repiten en el tiempo. Por ejemplo, en la figura 3 se ve el perfil ambulatorio de glucosa (AGP) de un paciente real, donde se aprecia un patrón de modesta variabilidad intra-día en relación a la elevación de la glucemia después del desayuno y sobre todo, después de comer, además de un riesgo de hipoglucemia nocturna/matutina por exceso de insulina basal; pero el hecho de que los rangos intercuartílicos (percentiles 25-75, banda azul de la figura) y el de los percentiles 5-95 (banda gris) sean tan estrechos, demuestra que la variabilidad entre-días es muy baja, dando a entender que esta persona en particular tiene poca variabilidad entre-días (probablemente por hábitos también poco variables). Sin embargo, en el ejemplo de AGP de la figura 4, vemos como es mucho más difícil identificar un patrón claro (salvo un modesto defecto de basal), con un rango intercuartílico amplio y un rango en los percentiles 5-95 aún más grande, que esconden seguramente una gran variabilidad tanto intra-día como entre-días, con una dificultad para optimizar la dosis de insulina rápida sobre todo en la cena (y/o horarios de comidas, especialmente la cena, muy diferentes), con resultados claramente muy dispares en días distintos. En este caso, encontrar patrones llevará más trabajo: por ejemplo, la gran variabilidad después de la cena podría deberse a gran hiperglucemia los fines de semana en relación a salidas con omisión de insulina. En cualquier caso, una vez encontrados los patrones, se intentará buscar sus causas, cruzando la información clínica (horarios de ingesta, deporte, etc..) con la que se obtiene de los monitores de glucosa intersticial o, en su defecto, de la monitorización capilar, (aunque esta ofrece una visión más pobre y menos fiable) y, de estar disponibles, de otros sensores como los relojes ‘inteligentes’ (”Smart watches”) que pueden ofrecer datos de actividad física, estrés, etc.
El proceso de análisis descrito es costoso, pero muy útil para reducir variabilidad.
Por otra parte, el trabajo de identificación de las fuentes de variabilidad no es siempre fructífero, con un porcentaje significativo de eventos glucémicos ‘inexplicables’: todos los implicados en el tratamiento de la DM1, han oído decir “¿cómo es posible que haciendo siempre lo mismo obtengo resultados distintos?”. En otras palabras, de momento hay que asumir que, por mucho interés y medios que pongamos las personas con DM1 y los sanitarios implicados en su tratamiento, la variabilidad glucémica se podrá reducir, pero difícilmente se podrá eliminar (es decir, alcanzar la observada en personas sin diabetes).
Como decíamos antes, las causas de la elevada variabilidad glucémica son varias (y no todas conocidas):
- La variabilidad en la farmacocinética de las insulinas subcutáneas. Es probablemente una de las más estudiadas (7). Con ella nos referimos a que, tras la inyección de una determinada dosis de una insulina, no obtenemos siempre las mismas concentraciones plasmáticas de insulina, y por lo tanto el mismo efecto. Este tipo de variabilidad, que es mayor con las insulinas basales (” lentas”) que con las prandiales (rápidas), contribuye hoy en día, de forma más limitada que en el pasado, al conjunto de la variabilidad glucémica. De hecho, el desarrollo de los análogos de la insulina ha permitido obtener tanto una distribución más homogénea del efecto insulínico a lo largo de las 24 horas, como una mayor reproducibilidad de acción entre días (es decir, dada una misma dosis, el nivel de insulina en sangre es parecido día tras día). Estos dos aspectos son importantes puesto que una concentración estable a lo largo del día se asociará a menor variabilidad glucémica intradía (y menor riesgo de hipoglucemia), mientras que la reproducibilidad de acción se reflejará en una titulación de la dosis más fácil y segura (es evidente cómo una acción más predecible favorece encontrar la dosis de insulina basal adecuada para alcanzar y mantener un determinado objetivo glucémico): todos los que hayan probado la insulina NPH recordarán la necesidad de un resopón a la hora de acostarse para evitar la hipoglucemia nocturna (debido a su pico de acción a las 3-5 horas de la inyección), y la dificultad para obtener glucemias similares al despertarse (debido a la variabilidad de acción entre días). Como decíamos antes, los análogos basales actualmente disponibles han mejorado mucho en estos aspectos, aunque evidentemente sin eliminar del todo el problema.
- La presencia de complicaciones relacionadas con la enfermedad, en particular la lipohipertrofia y la neuropatía autonómica (8,9). La primera se refiere a una alteración del tejido subcutáneo, secundaria a la inyección repetida de insulina siempre en el mismo sitio (son esos ‘bultos’ que aparecen en los lugares de inyección cuando la técnica no es adecuada por rotación insuficiente), que aumenta la variabilidad en la absorción de la insulina, con las consecuencias explicadas en el punto anterior. La segunda, que por suerte es clínicamente relevante en una relativa minoría de pacientes, se asocia a una alteración del vaciado del estómago, que suele ser más lento y menos predecible, y que hace difícil prever las excursiones glucémicas post-prandiales con hiper e hipoglucemias inesperadas.
- El ejercicio físico es uno de los factores con mayor impacto potencial sobre la glucemia, pero la predicción de su efecto es muy compleja debido a la heterogeneidad de las respuestas en función del tipo de actividad (no es lo mismo realizar ejercicio aeróbico de baja intensidad que ejercicio interválico de alta intensidad o ejercicios de fuerza). Adicionalmente, los datos relativos a la interacción entre el momento de la ingesta y del ejercicio (antes, inmediatamente después o post ingesta), así como los comportamientos adoptados para compensarlo, que pueden condicionar de forma relevante la respuesta glucémica, son escasos. Todo ello contribuye a que las recomendaciones relativas al ajuste del tratamiento insulínico en el contexto del ejercicio sean muy complejas y requieran individualización (10) (guía RECORD, actualizada en 2021), a pesar de la cual a menudo es complicado evitar hipo o hiperglucemias indeseadas.
- La variabilidad en el momento de la inyección de insulina rápida con respecto a la ingesta, otro error en la técnica de inyección, es una barrera significativa para el buen control glucémico (11). El problema más frecuente es la inyección después de haber comido, con el consecuente riesgo de hiperglucemia en el período post-prandial precoz, e hipoglucemia más tardía. Un extremo de este aspecto, mucho más frecuente de lo que se cree, es la omisión de la dosis de insulina (voluntaria o por olvido) con la consecuente hiperglucemia incluso con cantidades ‘pequeñas’ de CHO: hay que recordar que cantidades de 15-30 g de CHO, si son ingeridas sin inyección de insulina pueden tener un impacto importante sobre la glucemia. Afortunadamente, este aspecto es al menos teóricamente de más fácil solución, y puede mejorar con la difusión de las plumas ‘inteligentes’ que deberían ayudarnos a reducir el número de inyecciones olvidadas.
- De todos los factores mencionados, la composición nutricional de la ingesta es probablemente uno de los factores predominantes. De hecho, hay evidencias del efecto significativo de la distinta composición nutricional en la glucemia postprandial (12). Cada vez existe más evidencia de que los hidratos de carbono (HC) no son los únicos determinantes de las excursiones glucémicas, con un papel significativo tanto de las proteínas como de las grasas. Las primeras parecen contribuir de forma neta, incrementando per se (es decir, incluso sin la ingesta concomitante de HC) los niveles glucémicos post-prandiales; las segundas, sin embargo, parecen modificar el perfil de la glucemia post-prandial, cuando se consumen en una comida mixta, sin modificar la glucemia media, reduciendo el pico glucémico a las 1,5-3 h y prolongando su elevación en las horas siguientes (probablemente actúen ralentizando el vaciado gástrico). Adicionalmente, aunque los datos son limitados, el consumo de alcohol con la comida parece aumentar los niveles de glucosa en la fase post-prandial tardía (4-6 h después de la ingesta) (13). El tema es aún más complejo si consideramos el posible papel de la microbiota intestinal en el metabolismo glucídico. Datos recientes en sujetos sanos y con prediabetes demuestran la asociación significativa entre la presencia de distintas poblaciones microbianas y la respuesta glucémica post-prandial (14). El aspecto más interesante es la variabilidad interpersonal de la respuesta a un mismo alimento, que se explica, al menos en parte, por las diferencias en la microbiota y que podría ser otra causa de la heterogeneidad de la respuesta glucémica post-prandial en sujetos con DM1.
- Finalmente, y sin que esta lista sea exhaustiva, hay que tener en cuenta las variaciones de la sensibilidad insulínica, es decir la manera en la que nuestro organismo responde a una determinada concentración/dosis de insulina. Estas se pueden deber a enfermedad (a menudo durante una gripe, así como otras enfermedades comunes, es necesario incrementar la dosis de insulina para mantener un control adecuado), al ciclo menstrual y al embarazo en las mujeres, a variaciones en la actividad física habitual, etc. y hace más difícil la tarea de mantener glucemias estables.
Conclusiones
En resumen, las causas de variabilidad son muchas, y en parte no caracterizadas. De hecho, aunque es cierto que buena parte se puede explicar por errores de administración (incluyendo omisión) de insulina, hábitos de vida erráticos, ejercicio físico, etc., por otro lado, hay personas con DM1 que, a pesar de tener controlados esos factores, siguen teniendo una variabilidad glucémica muy elevada. Una posible contribución a esa heterogeneidad interindividual (entre individuos distintos), podría residir en la composición de la población microbiana intestinal (al menos en lo que respecta a la variabilidad intra-día, con mayores excursiones glucémicas post-prandiales en relación a mayor insulin-resistencia), pero faltan aún datos concluyentes al respecto. En cualquier caso, la solución a esta variabilidad tiene que seguir basándose en una educación diabetológica excelente, con un análisis exhaustivo de los datos de la MCG y de los hábitos de cada uno. Una esperanza adicional para atajar la variabilidad, llega de los sistemas de control en asa cerrada (“páncreas artificial”) aunque, al menos por el momento, tampoco estos sistemas pueden prescindir de una educación diabetológica de calidad.
Bibliografía
- Gorst C, Kwok CS, Aslam S, Buchan I, Kontopantelis E, Myint PK, et al. Long-term glycemic variability and risk of adverse outcomes: A systematic review and meta-analysis. Diabetes Care. 2015;38(12).
- D R. Glucose Variability: A Review of Clinical Applications and Research Developments. Diabetes Technol Ther [Internet]. 2018 Jun 1 [cited 2021 Jul 28];20(S2):S25–216. Available from: https://pubmed.ncbi.nlm.nih.gov/29916742/
- Helleputte S, de Backer T, Calders P, Pauwels B, Shadid S, Lapauw B. THE ADDED AND INTERPRETATIVE VALUE OF CGM-DERIVED PARAMETERS IN TYPE 1 DIABETES DEPENDS ON THE LEVEL OF GLYCEMIC CONTROL. Endocr Pract. 2021;27(1).
- Leahy JL, Aleppo G, Fonseca VA, Garg SK, Hirsch IB, McCall AL, et al. Optimizing Postprandial Glucose Management in Adults With Insulin-Requiring Diabetes: Report and Recommendations. 2019;3(10). Available from: https://academic.oup.com/jes/article/3/10/1942/5581189
- KJ B, AW B, P P, S C, JC BM. Efficacy of carbohydrate counting in type 1 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol [Internet]. 2014 Feb [cited 2021 Jul 28];2(2):133–40. Available from: https://pubmed.ncbi.nlm.nih.gov/24622717/
- V G, N T, A RF, L L, R RL. The challenges of achieving postprandial glucose control using closed-loop systems in patients with type 1 diabetes. Diabetes Obes Metab [Internet]. 2018 Feb 1 [cited 2021 Jul 28];20(2):245–56. Available from: https://pubmed.ncbi.nlm.nih.gov/28675686/
- Guerci B, Sauvanet JP. Subcutaneous insulin: Pharmacokinetic variability and glycemic variability. Vol. 31, Diabetes and Metabolism. 2005.
- Chang J, Rayner CK, Jones KL, Horowitz M. Diabetic gastroparesis and its impact on glycemia. Vol. 39, Endocrinology and Metabolism Clinics of North America. 2010.
- Chowdhury TA. Poor glycaemic control caused by insulin induced lipohypertrophy. BMJ. 2003;327(7411).
- Gargallo-Fernández M, Escalada San Martín J, Gómez-Peralta F, Rozas Moreno P, Marco Martínez A, Botella-Serrano M, et al. Clinical recommendations for sport practice in diabetic patients (RECORD Guide). Diabetes Mellitus Working Group of the Spanish Society of Endocrinology and Nutrition (SEEN). Endocrinologia y Nutricion. 2015;62(6).
- Slattery D, Amiel SA, Choudhary P. Optimal prandial timing of bolus insulin in diabetes management: a review. Vol. 35, Diabetic Medicine. 2018.
- Bell KJ, Smart CE, Steil GM, Brand-Miller JC, King B, Wolpert HA. Impact of fat, protein, and glycemic index on postprandial glucose control in type 1diabetes: Implications for intensive diabetes management in the continuous glucose monitoring era. Diabetes Care. 2015 Jun 1;38(6):1008–15.
- García A, Moscardó V, Ramos-Prol A, Díaz J, Boronat M, Bondia J, et al. Effect of meal composition and alcohol consumption on postprandial glucose concentration in subjects with type 1 diabetes: a randomized crossover trial. BMJ Open Diabetes Research & Care. 2021;9(1).
- Zeevi D, Korem T, Zmora N, Israeli D, Rothschild D, Weinberger A, et al. Personalized Nutrition by Prediction of Glycemic Responses. Cell. 2015 Nov 19;163(5):1079–94.







