Con el incremento de la prevalencia de obesidad y diabetes a nivel mundial, una autentica epidemia en el siglo XXI, la esteatosis hepática se ha convertido en un problema de salud pública, siendo la complicación que más rápidamente ha crecido en los últimos 20 años (2), y en la actualidad la segunda causa de trasplante hepático (1).
Antes conocida como NAFLD (non alcoholic fatty liver desease), recientemente se ha propuesto el término disfunción metabólica asociada a esteatosis hepática (metabolic dysfunction-associated steatotic liver disease; MASLD) porque según el método delphy utilizado para el acuerdo, describe mejor la disfunción asociada al hígado graso, evitando de esta forma el estigma del alcohol y el termino fatty, que en inglés se traduce por gordo además de graso (3).
Prevalencia
MASLD se define como la infiltración grasa en el hígado de al menos el 5 % de los hepatocitos, medida por técnica de imagen o por histología (4).
Su prevalencia general es del 37.8 % y es mayor en hombres que en mujeres (39.7 vs 25.6 respectivamente) (5). Además ejerce sinergia en sus efectos deletéreos con la diabetes mellitus tipo 2 (DM2) con la que además coexiste, estimándose que la prevalencia de MASLD en pacientes con diabetes alcanza el 55.5% (6).
Comorbilidades asociadas
- Obesidad: El exceso de peso corporal, en particular la obesidad central (grasa alrededor del abdomen), está fuertemente asociado con la MASLD, aunque hay pacientes con MASLD delgados, especialmente en razas asiáticas, generalmente con mejor evolución. La obesidad se asocia con:
-
- Síndrome metabólico: Se refiere a un conjunto de afecciones que incluyen obesidad abdominal, hipertensión arterial, hiperglucemia y niveles anormales de colesterol o triglicéridos. Las personas con síndrome metabólico corren un mayor riesgo de padecer MASLD.
- Dieta: El consumo elevado de carbohidratos refinados, alimentos y bebidas azucaradas y grasas saturadas, puede contribuir a MASLD.
- Sedentarismo: La falta de actividad física es un factor de riesgo de MASLD. El ejercicio regular puede ayudar a prevenir y controlar la enfermedad.
- Resistencia a la insulina y DM2.
- Edad: MASLD es más frecuente a medida que aumenta la edad, aunque puede aparecer a cualquier edad. Hay un incremento a partir de los 45 años.
- Genética: Parece existir una predisposición genética.
- Otras enfermedades como el síndrome de ovario poliquístico, la apnea del sueño y el hipotiroidismo se asocian con MASLD.
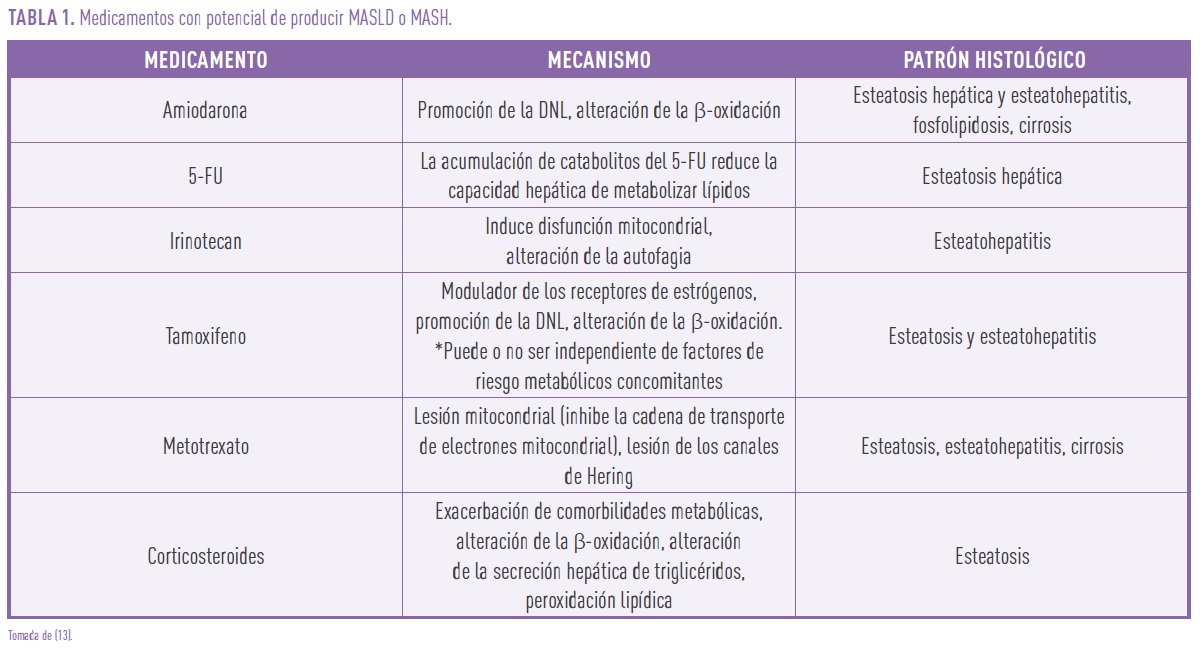
- Medicamentos como los corticosteroides, el tamoxifeno y ciertos antirretrovirales (tabla 1).
- Microbiota: Las alteraciones en la composición de la microbiota intestinal parecen estar también implicadas en el desarrollo de MASLD.
- Origen étnico: en particular las poblaciones hispana y asiática.
- Factores medioambientales (7).
Diagnóstico
El diagnóstico de MASLD suele plantearse cuando las aminotransferasas hepáticas están elevadas o mas frecuentemente, cuando las imágenes abdominales detectan grasa hepática de forma incidental. Con menor frecuencia, se sospecha de MASLD cuando existen comorbilidades metabólicas y deberíamos estudiarla en todos los pacientes con factores de riesgo para su desarrollo.
El diagnostico de MASLD se caracteriza por esteatosis hepática detectada por imagen o biopsia, más al menos 1 de 5:
- IMC ≥ 25 kg/m2 (≥ 23 kg/m2 en asiáticos) o perímetro de cintura > 94 cm en hombres, > 80 cm en mujeres, o ajustada a la etnia.
- Glucosa sérica en ayunas ≥ 100 mg/dl (≥ 5,6 mmol/L) o nivel de glucosa a las 2 horas tras la sobrecarga oral de glucosa ≥ 140 mg/dl (≥ 7,8 mmol/L) o HbA1c ≥ 5,7% o en tratamiento farmacológico específico.
- Tensión arterial ≥ 130/85 mmHg o tratamiento farmacológico específico.
- Triglicéridos plasmáticos ≥ 150 mg/dl (≥ 1,70 mmol/L) o tratamiento farmacológico específico.
- Colesterol HDL plasmático < 40 mg/dl (< 1,0 mmol/L) para los hombres y < 50 mg/dl (< 1,3 mmol/L) para las mujeres o tratamiento farmacológico específico (8).
Los valores de transaminasas, especialmente AST, pueden estar levemente elevados, pero también pueden ser normales incluso en pacientes con cirrosis.
La progresión a fibrosis y el desarrollo de esteatohepatitis (MASH en inglés) es lo que marca el pronóstico de la enfermedad, dado que puede acabar en cirrosis y en el desarrollo de hepatocarcinoma, mientras que los pacientes con MASLD se asocian más a mortalidad cardiovascular.

MASH es la forma más grave de la MASLD y se define histológicamente por la presencia de inflamación lobular y abombamiento de los hepatocitos (balonización), y se asocia a un mayor riesgo de progresión de la fibrosis (9). Se ha detectado MASH en el 63% de los pacientes con MASLD sometidos a biopsia hepática en una cohorte asiática multicéntrica (10). Entre los pacientes con MASLD sin indicación de biopsia hepática, la prevalencia de MASH es del 7% (6). Aunque la enfermedad cardiovascular (ECV) es la principal causa de mortalidad en pacientes con MASLD, aquellos con fibrosis hepática más grave tienen un mayor riesgo de mortalidad relacionada con el hígado, y el riesgo aumenta exponencialmente con el estadio de fibrosis (11).
El diagnostico de MASLD permite la existencia de otras patologías asociadas como la hepatitis viral y MASLD o hepatitis autoinmune (12) además de asociarse a cáncer extrahepático como estómago, riñón, mama, vesícula y via biliar, colon y recto.
Dentro del diagnóstico diferencial es importante tener en cuenta el llamado MetALD, que es la esteatosis asociada al consumo de alcohol mayor de 20 g/día en la mujer o mayor de 30 g/día en el hombre.
Otras causas de MASLD son las enfermedades hepáticas metabólicas como, deficiencia lisosomal de lipasa acida, enfermedad de Wilson, hipobetalipoproteinemia, errores innatos del metabolismo, hepatitis C genotipo 3, malnutrición, enfermedad celiaca, VIH y algunos factores medioambientales (12).
EL DIAGNÓSTICO DE MASLD SUELE PLANTEARSE CUANDO LAS AMINOTRANSFERASAS ESTÁN ELEVADAS O MAS FRECUENTEMENTE, CUANDO LAS IMÁGENES ABDOMINALES DETECTAN GRASA HEPÁTICA DE FORMA INCIDENTAL
La forma mas habitual del diagnóstico es de forma incidental en una ecografía abdominal solicitada por otras causas.
Se debe sospechar en todos los pacientes con factores de riesgo, obesidad, diabetes, síndrome metabólico, hiperlipemia, HTA, etc.
Una vez sospechada, deberíamos pedir una analítica con transaminasas (AST y ALT), hemograma y perfil lipídico para poder realizar algunos sencillos cálculos como el fatty liver index (FLI) que con variables rutinarias permite calcular la probabilidad de tener MASLD.
Lo más común es solicitar una ecografía abdominal y comparar la ecogenicidad hepática con la de la corteza renal, que debe ser la misma y en caso de esteatosis está aumentada. La ecografía no es capaz de detectar los primeros estadios de la esteatosis, dado que solo detecta si la proporción de hepatocitos afectados es mayor del 12%.
Una vez realizado el diagnostico de MASLD, es fundamental descartar la presencia de fibrosis y para ello, las guías recomiendan utilizar el índice FIB-4 (figura 1) que con los datos habituales de consulta resulta fácil de calcular. El resultado puede ser tres tipos diferentes:
- Pacientes con resultado menor de 1.3: la probabilidad de esteatosis es muy pequeña y podemos reevaluarlo de forma anual si presenta factores de riesgo, o cada tres años en pacientes delgados sin factores de riesgo.
- Los pacientes con resultado entre 1.3 y 2.67, la probabilidad de presentar fibrosis es media y deberíamos pedir una prueba como el fibroscan que nos lo confirme.
- Pacientes con resultado mayor de 2.67, deberíamos remitirlos a la consulta de digestivo.
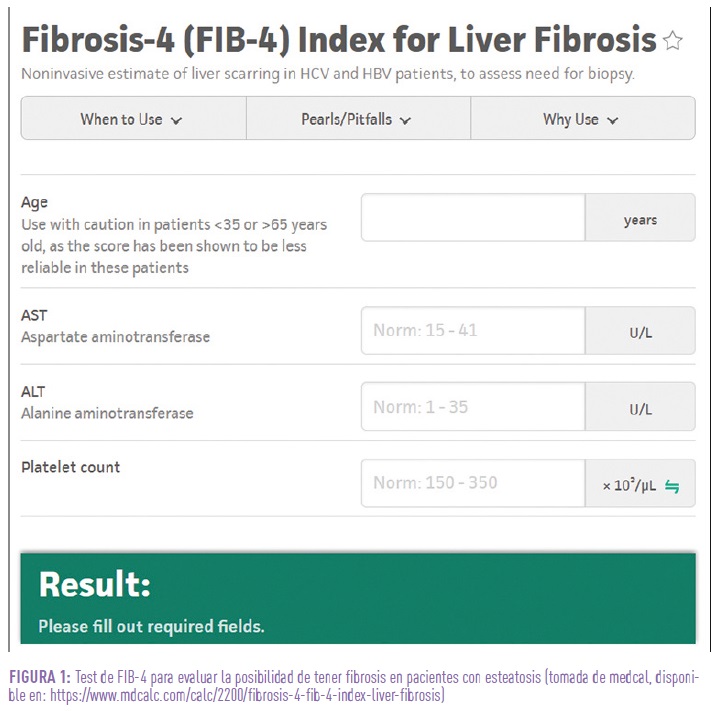
En pacientes > 65 años, podemos elevar el punto de corte de > 1.3 a > 2.
Los resultados de fibroscan correlacionan muy bien con los grados de fibrosis que encontramos en la anatomía patológica y el resultado se expresa en KPa.
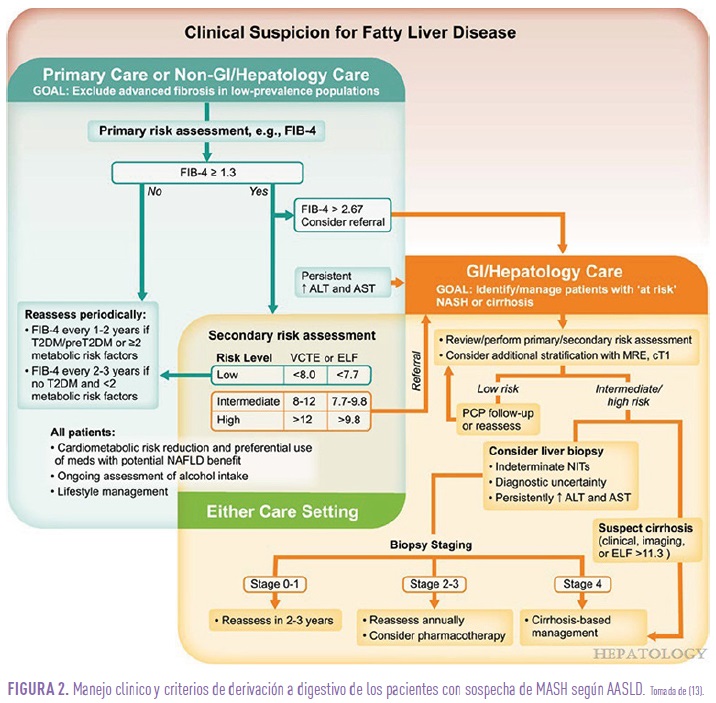
Criterios de derivación a digestivo: (figura 2)
- Pacientes con FIB-4 > 2.67, para valorar si realizar fibroscan o directamente una biopsia.
- Pacientes con resultados de fibroscan > 8 KPa, que corresponde a un grado de fibrosis F2.
- Los pacientes con FIB-4 mayor de 1.3 y menor de 2.67, deberían someterse a un fibroscan y en caso de ser < 8 KPa, se repetirá al año y si es > 8 KPa se derivará a digestivo para valorar biopsia (13).
- Pacientes con elevación de transaminasas persistente durante más de 6 meses.
Tratamiento
Como cualquier enfermedad metabólica, la pauta nutricional y el ejercicio forman parte fundamental del tratamiento de los pacientes con MASLD.
- Incluso en pacientes que no pierden peso, el ejercicio mejora el riesgo cardiovascular además de mejorar las comorbilidades asociadas y el depósito graso a nivel hepático.
- Perdidas modestas de peso de solo 3 a 5 % mejoran MASLD, pero para mejorar MASH y la fibrosis son necesarias perdidas mayores al 10 % del peso. El mantener la pérdida de peso supone un reto para familiares y profesionales, siendo necesario un equipo multidisciplinar.
- La dieta hipercalórica, particularmente rica en grasas saturadas, así como el excesivo consumo de fructosa, aumentan el riesgo de MASLD independientemente de la ingesta calórica. La dieta mediterránea es la recomendada para el tratamiento de esta patología. Por otra parte, el consumo de 3 cafés al día puede ser beneficioso.
- La cirugía bariátrica es una opción para pacientes con IMC > 40, o > 35 con comorbilidades, resolviendo MASH y mejorando la fibrosis hepática.
- Medicación:
-
- Vitamina E: 800 U/dia mejora la esteatosis, pero no tenemos datos de beneficios sobre la fibrosis.
- Pioglitazona: único fármaco que ha demostrado disminuir la fibrosis hepática y mejorar la esteatosis pese a la ganancia ponderal que produce.
- Liraglutide: es un arGLP-1 utilizado para el tratamiento de la diabetes que mejora el riesgo cardiovascular, favorece la pérdida de peso y mejora la esteatosis, pero no la fibrosis.
- Semaglutide: arGLP-1 aprobado para el tratamiento de la diabetes y la obesidad a dosis de 0.25 hasta 2.4 mg semanales. Mejora la esteatosis y frena la MASH pero no tenemos resultados sobre la fibrosis, aunque parece que enlentece la evolución.
- Tirzepatide: Aún no comercializado en España, es un agonista dual arGLP-1 y GIPaprobado en ficha técnica para el tratamiento de diabetes y obesidad. Produce una muy significativa pérdida de peso, reduciendo la esteatosis en las pruebas de imagen.
- iSGLT-2: Aprobados para el tratamiento de la enfermedad renal crónica, la insuficiencia cardiaca y la diabetes mellitus tipo 2, mejoran la esteatosis medida por imagen. Producen una modesta pérdida de peso.
- Otros fármacos como la metformina, el ácido ursodesoxicolico, las estatinas, ácido obeticolico, elafibranor, saroglitazar, etc. no han demostrado beneficios.
MASLD SE DEFINE COMO LA INFILTRACIÓN GRASA EN EL HÍGADO DE AL MENOS EL 5 % DE LOS HEPATOCITOS, MEDIDA POR TÉCNICA DE IMAGEN O POR HISTOLOGÍA
Consejos para la consulta
- Sospecharlo en pacientes con DM2, HTA, hiperlipemia, obesidad, factores de riesgo cardiovascular o leve aumento de transaminasas.
- Las transaminasas pueden ser normales incluso en presencia de cirrosis.
- MASLD aumenta la mortalidad cardiovascular y MASH aumenta el riesgo de cirrosis, hepatocarcinoma y tumores extrahepáticos.
- Diagnosticarlo por ecografía o FLI.
- Descartar fibrosis con FIB-4.
- Si FIB-4 > 1.3 y < 2.67 pedir fibroscan, si < 1.3 repetir en dos o tres años, o anualmente si existen factores de riesgo.
- Derivar a digestivo si el fibroscan es mayor de 8KPa o FIB-4 > 2.67 o hipertransaminasemia mantenida más de 6 meses.
- Aunque no hay ningún fármaco autorizado para el tratamiento de MASH, la pioglitazona ha demostrado disminuir la fibrosis hepática en MASH, por lo que debe ser el tratamiento de elección.
Bibliografía
- Cotter TG, Charlton M. Nonalcoholic Steatohepatitis After Liver Transplantation. Liver Transpl. 2020 Jan;26(1):141–59.
- Adam R, Karam V, Cailliez V, O Grady JG, Mirza D, Cherqui D, et al. 2018 Annual Report of the European Liver Transplant Registry (ELTR) – 50-year evolution of liver transplantation. Transpl Int. 2018 Dec;31(12):1293–317.
- Rinella ME, Lazarus JV, Ratziu V, Francque SM, Sanyal AJ, Kanwal F, et al. A multisociety Delphi consensus statement on new fatty liver disease nomenclature. Annals of Hepatology [Internet]. 2024 Jan 1 [cited 2024 Feb 15];29(1):101133. Available from: https://www.sciencedirect.com/science/article/pii/S1665268123002375
- Nachit M, Kwanten WJ, Thissen JP, Op De Beeck B, Van Gaal L, Vonghia L, et al. Muscle fat content is strongly associated with NASH: A longitudinal study in patients with morbid obesity. Journal of Hepatology [Internet]. 2021 Aug 1 [cited 2024 Feb 19];75(2):292–301. Available from: https://www.sciencedirect.com/science/article/pii/S0168827821002348
- Riazi K, Azhari H, Charette JH, Underwood FE, King JA, Afshar EE, et al. The prevalence and incidence of NAFLD worldwide: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2022 Sep;7(9):851–61.
- Younossi ZM, Golabi P, Avila L de, Paik JM, Srishord M, Fukui N, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta-analysis. Journal of Hepatology [Internet]. 2019 Oct 1 [cited 2024 Feb 19];71(4):793–801. Available from: https://www.journal-of-hepatology.eu/article/S0168-8278(19)30393-9/abstract
- Juanola O, Martínez-López S, Francés R, Gómez-Hurtado I. Non-Alcoholic Fatty Liver Disease: Metabolic, Genetic, Epigenetic and Environmental Risk Factors. Int J Environ Res Public Health [Internet]. 2021 May 14 [cited 2024 Feb 27];18(10):5227. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8155932/
- Chan WK, Chuah KH, Rajaram RB, Lim LL, Ratnasingam J, Vethakkan SR. Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD): A State-of-the-Art Review. J Obes Metab Syndr [Internet]. 2023 Sep 30 [cited 2024 Feb 20];32(3):197–213. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10583766/
- Singh S, Allen AM, Wang Z, Prokop LJ, Murad MH, Loomba R. Fibrosis progression in nonalcoholic fatty liver vs nonalcoholic steatohepatitis: a systematic review and meta-analysis of paired-biopsy studies. Clin Gastroenterol Hepatol. 2015 Apr;13(4):643-654.e1-9; quiz e39-40.
- Chan WK, Treeprasertsuk S, Imajo K, Nakajima A, Seki Y, Kasama K, et al. Clinical features and treatment of nonalcoholic fatty liver disease across the Asia Pacific region-the GO ASIA initiative. Aliment Pharmacol Ther. 2018 Mar;47(6):816–25.
- Dulai PS, Singh S, Patel J, Soni M, Prokop LJ, Younossi Z, et al. Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: Systematic review and meta-analysis. Hepatology. 2017 May;65(5):1557–65.
- Kanwal F, Neuschwander-Tetri BA, Loomba R, Rinella ME. Metabolic dysfunction-associated steatotic liver disease (MASLD): Update and impact of new nomenclature on the AASLD clinical practice guidance on nonalcoholic fatty liver disease. Hepatology [Internet]. [cited 2024 Feb 20];10.1097/HEP.0000000000000670. Available from: https://journals.lww.com/hep/citation/9900/metabolic_dysfunction_associated_steatotic_liver.634.aspx
- Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, Abdelmalek MF, Caldwell S, Barb D, et al. AASLD Practice Guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology [Internet]. 2023 May [cited 2023 May 9];77(5):1797. Available from: https://journals.lww.com/hep/Fulltext/2023/05000/AASLD_Practice_Guidance_on_the_clinical_assessment.31.aspx







