La insulina es la terapia sustitutiva que tenemos disponible cuando falla la función del páncreas endocrino. Constituye el pilar básico del tratamiento de la diabetes tipo 1 (DM1) y es muy importante en el manejo de otros tipos de diabetes (diabetes monogénicas, esteroidea, diabetes relacionada con fibrosis quística, diabetes gestacional y diabetes tipo 2).
En una persona sin diabetes el páncreas secreta insulina de forma inmediata tras la ingesta y mantiene, además, una secreción de insulina a dosis baja en periodos de no ingesta, para conseguir que los niveles de glucosa en sangre se mantengan siempre en el estrecho rango de normalidad fisiológica. El objetivo de la insulinoterapia es sustituir la secreción pancreática de insulina e imitar al máximo la acción fisiológica de la insulina endógena cuando falla la función del páncreas endocrino.
La insulina es una proteína formada por aminoácidos. Los análogos de insulina de acción rápida (AAR) son modificaciones de la molécula de insulina humana que se han desarrollado para conseguir una acción más similar a la insulina endógena. Actualmente, existen diferentes formulaciones de AAR que se han ido sintetizando para simular al máximo, tanto los picos posprandiales como la secreción basal continua de la insulina endógena. El objetivo teórico que se persigue utilizando los AAR es conseguir controlar los picos de hiperglucemia posprandiales, disminuir las hipoglucemias y mejorar la calidad de vida de los pacientes con diabetes.
Haciendo un recuerdo histórico, en el último cuarto del siglo XIX se descubrió la relación entre el páncreas y la aparición de DM1. A partir de ese momento, se iniciaron una serie de investigaciones a nivel internacional para conseguir la sustancia que conseguía la disminución de la glucosa. Finalmente hace casi un siglo, en 1922, F.G. Bantin, C.H. Best, J.B. Collip y J.J.R. Macleod consiguieron aplicar un extracto de páncreas animal de forma exitosa en un chico de 14 años con DM1, Leonard Thompson. Este hecho supuso un punto de inflexión en el tratamiento de las personas con DM1, se inició la producción masiva de insulinas inicialmente bovinas y porcinas, con diferentes propiedades farmacocinéticas y farmacodinámicas. Finalmente, la producción en laboratorio de insulina biosintética humana en 1978 y la ulterior secuenciación del gen que la regula, permitió su producción masiva y la aparición de análogos de insulina recombinantes (1).
Otros hitos importantes en la historia de la insulinoterapia han sido la aparición de las bombas de administración de insulina, cuyo desarrollo se inició en la década de los 60, y la terapia bolo-basal, concepto iniciado a principios de los 80, que han supuesto una mejora en la terapia y en la calidad de vida de las personas con diabetes (1).
ANÁLOGOS DE INSULINA DE ACCIÓN RÁPIDA
Las insulinas se clasifican según el inicio, el pico máximo y la duración de su acción. La insulina regular humana tiene un inicio de acción lento y una mayor duración de efecto si la comparamos con la insulina endógena. Esto obliga a que los pacientes tengan que esperar un tiempo variable (20-40 minutos) desde que se administran la insulina hasta que pueden comer. Por otra parte, a pesar de esto, es difícil evitar un pico de hiperglucemia postprandial y en algunas situaciones una hipoglucemia posterior porque la duración de acción de estas insulinas es demasiado prolongada.
Los análogos de insulina de acción rápida son moléculas de insulina cuya estructura de aminoácidos ha sido modificada mediante ingeniería genética y tecnología de ADN recombinante, para adaptar mejor su función a la ingesta de carbohidratos, en comparación con las dificultades que existen con la insulina regular humana. Para variar estas propiedades, en el caso de los AAR, se utilizan soluciones de insulina hexaméricas cuyos enlaces pueden ser más o menos fuertes, lo que enlentece en mayor o menor medida la fragmentación en monómeros de insulina a nivel subcutáneo, que son los que entran al torrente sanguíneo y actúan.
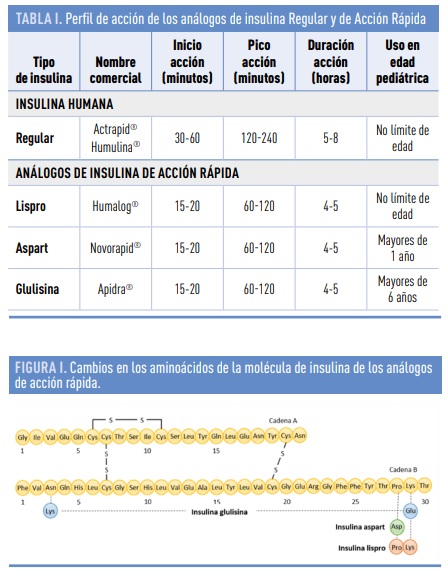
De esta manera se desarrollaron varios AAR cuyos perfiles de acción pueden verse en la Tabla 1. La primera en aparecer fue la insulina lispro, aprobada por la FDA (Food and Drug Administration) de USA en 1996 y que se diferencia de la molécula humana por un intercambio de los aminoácidos prolina y lisina en las posiciones 28 y 29 de la cadena B de la insulina. Posteriormente, en los años 2000 y 2004 fueros aprobadas la insulina aspart (reemplazo de la prolina de la posición 28 de la cadena B, por aspártico) y la glulisina (reemplazo de arginina por lisina en la posición 3 y de la lisina por ácido glutámico en la posición 29 de la cadena B), respectivamente (Figura 1).
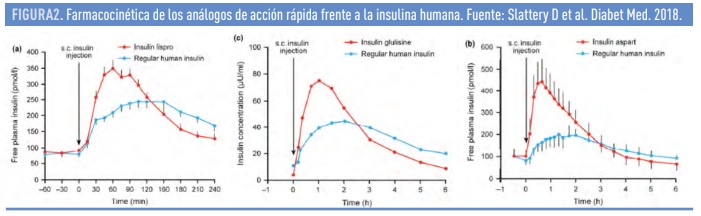
Estas variaciones permiten un inicio de acción y pico de máximo efecto más rápidos y una menor duración en comparación con la insulina humana (Figura 2). Estos hechos permiten que se deba esperar menos tiempo entre la administración del análogo y la ingesta, un mejor control de las hiperglucemias postprandiales y menor frecuencia de hipoglucemias postprandiales tardías (2,3). Estas mejoras permiten, potencialmente, un control metabólico más favorable y una mejoría de la calidad de vida de las personas con DM1.
A pesar de los beneficios teóricos esperados, diferentes metaanálisis muestran solo una discreta mejoría con el uso de AAR frente a insulina regular en la mejoría de la hemoglobina glicosilada y en la disminución de los eventos de hipoglucemia en pacientes con DM1, sin que se hayan observado diferencias significativas en pacientes con DM2 (4-6). Es difícil demostrar de forma metodológicamente correcta la posible mejoría en la calidad de vida, y no hay datos que estudien los posibles beneficios del uso de AAR en otros parámetros muy importantes a la hora de medir el control metabólico de los pacientes, como son el tiempo en rango y la variabilidad glucémica.
Sí se ha demostrado una mejoría del control glucémico con el uso de bombas de insulina con respecto a los regímenes de inyección múltiple (7). En un futuro será necesario evaluar los efectos de los AAR en la disminución de las complicaciones crónicas de la diabetes.
EL DÍA A DÍA CON ADMINISTRACIÓN DE INSULINA
A pesar de estos resultados modestos, es importante valorar las mejoras que han supuesto el uso de los AAR en la calidad de vida de los pacientes. Previamente, se utilizaba la insulina regular preprandial siendo necesario administrarla al menos 30 minutos antes de una comida para evitar las excursiones posprandiales. Como la duración de su efecto es prolongada existía un importante riesgo de hipoglucemias unas horas después de la ingesta.
Frente a esta situación, los análogos de AAR, e incluso más los de segunda generación, que son objetivo de otro capítulo de la revista, permiten disminuir el intervalo entre la administración de insulina y la ingesta (8). Esto supone una ventaja en la vida real y especialmente en diferentes escenarios, incluyendo salidas sociales, donde es difícil saber la ingesta con antelación, días de enfermedad, o en el caso de la población pediátrica, con ingestas menos controlables “a priori” en cuanto inicio y cumplimiento de raciones de hidratos de carbono.
Un aspecto importante que repercute en la calidad de vida, y en la aparición de complicaciones micro/macrovasculares a largo plazo en personas con diabetes, es la existencia e intensidad de las excursiones glucémicas posprandiales. Para conseguir limitarlas al máximo, hay que tener varios factores en cuenta. Junto al conocimiento del contenido nutricional de las ingestas (hidratos de carbono de absorción lenta/rápida, grasas y proteínas) y el ajuste adecuado de las dosis de insulina preprandial, influye el tiempo de espera necesario desde la administración de insulina hasta el inicio de la ingesta. Utilizando AAR se recomienda que sea entre 15-20 minutos en normoglucemia. Está demostrado que si se administran coincidiendo con el inicio de la ingesta o incluso después de la misma, las glucemias posprandiales son más elevadas y hay mayor riesgo de hipoglucemias posteriores (9). Debemos recordar la necesidad de evitar las grandes oscilaciones de glucemia, en la medida de lo posible dado que tienen implicaciones en el pronóstico a largo plazo de las personas con DM1 (10).
Otro aspecto relevante del tratamiento de la diabetes, al que ha contribuido la extensión en el uso de los AAR y los de acción ultrarrápida, ha sido el incremento de personas con diabetes en terapia con bombas de infusión de insulina. El principio básico de su funcionamiento es intentar conseguir un patrón de insulinoterapia más dinámico que con la terapia bolo-basal con múltiples dosis de insulina, con una perfusión continua de insulina basal a pequeñas dosis y, bolos activados en la mayoría de ocasiones por el paciente, para cubrir las comidas. A pesar de todo, la terapia no es perfecta y estamos a la espera de ver el posible beneficio real derivado de la experiencia del manejo con las nuevas insulinas de acción más rápida, ya autorizadas para esta indicación. Esta opción también puede aportar beneficios en el desarrollo de los sistemas de control de glucosa en “asa cerrada”, en los que la inmediatez de la acción es un punto clave para emular la secreción glandular in vivo.
Finalmente, queremos destacar que sin ninguna duda el desarrollo y generalización del uso de análogos de insulina de acción rápida ha supuesto un claro avance en el tratamiento de las personas con diabetes, especialmente DM1. A pesar de que tienen un coste superior a la insulina humana regular, en nuestro medio, los análogos son las insulinas prandiales de elección. La reducción en el número de hipoglucemias referidas en algunos estudios, y la ventaja al disminuir el tiempo de espera para la ingesta son hechos relevantes. Estamos a la espera de conocer el impacto real que conlleva la utilización masiva de los AAR de segunda generación, dado que su incorporación es muy reciente.
En un futuro próximo, es probable que sigan desarrollándose nuevas formulaciones de insulina con un perfil de acción aún más superponible a la insulina endógena. Este hecho junto con los avances tecnológicos en los sistemas de monitorización continua de glucosa, en los infusores continuos de insulina, y el perfeccionamiento de los sistemas integrados, hará posible una terapia sustitutiva más efectiva y segura para las personas con DM1.
BIBLIOGRAFÍA
- Vecchio I, Tornali C, Bragazzi NL, Martini M. The Discovery of Insulin: An Important Milestone in the History of Medicine. Front Endocrinol. 2018;9. doi:10.3389/fendo.2018.00613
- Hirsch IB, Juneja R, Beals JM, Antalis CJ, Wright EE. The Evolution of Insulin and How it Informs Therapy and Treatment Choices. Endocr Rev. 2020;41(5). doi:10.1210/endrev/bnaa015
- Rolla A. Pharmacokinetic and pharmacodynamic advantages of insulin analogues and premixed insulin analogues over human insulins: impact on efficacy and safety. Am J Med. 2008;121(6 Suppl):S9-S19. doi:10.1016/j.amjmed.2008.03.022
- Fullerton B, Siebenhofer A, Jeitler K, et al. Short‐acting insulin analogues versus regular human insulin for adults with type 1 diabetes mellitus. Cochrane Database Syst Rev. 2016;(6). doi:10.1002/14651858.CD012161
- Fullerton B, Siebenhofer A, Jeitler K, et al. Short‐acting insulin analogues versus regular human insulin for adult, non‐pregnant persons with type 2 diabetes mellitus. Cochrane Database Syst Rev. 2018;(12). doi:10.1002/14651858.CD013228
- Melo KFS, Bahia LR, Pasinato B, et al. Short-acting insulin analogues versus regular human insulin on postprandial glucose and hypoglycemia in type 1 diabetes mellitus: a systematic review and meta-analysis. Diabetol Metab Syndr. 2019;11. doi:10.1186/s13098-018-0397-3
- Misso ML, Egberts KJ, Page M, O’Connor D, Shaw J. Continuous subcutaneous insulin infusion (CSII) versus multiple insulin injections for type 1 diabetes mellitus. Cochrane Database Syst Rev. 2010;(1). doi:10.1002/14651858.CD005103.pub2
- Owens DR, Bolli GB. The continuing quest for better subcutaneously administered prandial insulins: a review of recent developments and potential clinical implications. Diabetes Obes Metab. 2020;22(5):743-754. doi:10.1111/dom.13963
- Slattery D, Amiel SA, Choudhary P. Optimal prandial timing of bolus insulin in diabetes management: a review. Diabet Med. 2018;35(3):306-316. doi:10.1111/dme.13525
- Wilmot EG, Choudhary P, Leelarathna L, Baxter M. Glycaemic variability: The under‐recognized therapeutic target in type 1 diabetes care. Diabetes Obes Metab. 2019;21(12):2599-2608. doi:10.1111/dom.13842