1. Introducción
El desarrollo de los agonistas del receptor de GLP-1 (arGLP-1) representa un hito histórico en el tratamiento de enfermedades de alta prevalencia como la diabetes tipo 2 (DM2) y la obesidad (1). Esta clase terapéutica mejora el control glucémico en la DM2 mediante la estimulación de la secreción de insulina y la reducción de la secreción de glucagón por un mecanismo dependiente del nivel de glucosa en sangre, lo que reduce el riesgo de hipoglucemia. Además, los arGLP-1 actúan sobre áreas del sistema nervioso central relacionadas con la ingesta energética, como el hipotálamo y el circuito de recompensa mesolímbico, induciendo una reducción del apetito, saciedad precoz y cambio en las preferencias alimentarias hacia productos con menos contenido calórico. Este efecto conduce a una pérdida ponderal clínicamente relevante a expensas de masa grasa, no solo subcutánea sino también visceral, cuyo acúmulo alrededor y en el interior de diversos órganos como el hígado, el corazón y el riñón es uno de los factores causales de la DM2 y la enfermedad cardiovascular (CV) (1).
La eficacia antihiperglucemiante y de pérdida de peso observada en los ensayos clínicos con los arGLP-1 es superior a la alcanzada con el resto de clases terapéuticas aprobadas en el tratamiento de la DM2, si excluimos a los agonistas duales de los receptores GLP-1/GIP, cuyo primer representante comercializado es la tirzepatida (2,3). Esta molécula muestra una eficacia sobre control glucémico y peso aún mayor que la observada con arGLP-1 potentes como semaglutida, probablemente debido a que al mecanismo de acción bien conocido sobre el receptor de GLP-1 se le suman efectos sobre el receptor de la incretina GIP en páncreas, sistema nervioso central y tejido adiposo, que aún están siendo estudiados (1-3).
Los arGLP-1 tienen, tanto en pacientes con y sin DM2, efectos beneficiosos directos sobre el miocardio y la placa aterosclerótica de la pared vascular, así como efectos beneficiosos indirectos sobre otros factores de riesgo CV, tales como la presión arterial, los lípidos, la albuminuria y la inflamación de bajo grado (1). Además, se han observado beneficios clínicos en otras patologías tales como la enfermedad renal crónica, la apnea del sueño, la esteatohepatitis asociada a la enfermedad metabólica o la artrosis de rodilla (1). Un metanálisis que incluyó aquellos ensayos clínicos centrados en la seguridad CV de los arGLP-1 en DM2 encontró reducciones significativas en un objetivo combinado de morbimortalidad CV (MACE-3: muerte CV, infarto de miocardio no mortal y accidente cerebrovascular no mortal), hospitalización por insuficiencia cardíaca y progresión de la enfermedad renal crónica (4). Recientemente, semaglutida, un arGLP-1 de administración semanal, ha demostrado en pacientes con obesidad y enfermedad CV establecida sin DM una reducción del 20% de morbimortalidad CV (5), y mejoría clínica de la insuficiencia cardiaca en pacientes con insuficiencia cardiaca con fracción de eyección preservada con y sin DM2 (1).
Los arGLP-1 comercializados actualmente con indicaciones para DM2 en nuestro país son liraglutida subcutánea (1,2-1,8 mg/día), dulaglutida subcutánea (0,75-1,5 mg/semana), semaglutida subcutánea (0,5-1,0 mg/semana) y semaglutida oral (7-14 mg/día). Tirzepatida subcutánea es el único agonista dual GLP-1/GIP aprobado para el tratamiento de la DM2 (5-10 mg/semana). Existen dosis superiores de estos fármacos comercializadas en otros países, pero no en España (semaglutida 2,0 mg sc semanal, dulaglutida 3,0 y 4,5 mg sc semanal, tirzepatida 15 mg sc semanal). Todos estos fármacos, excepto dulaglutida, precisan una fase inicial de escalada de dosis. La observación de que estos medicamentos conseguían pérdidas relevantes de peso en pacientes con DM2 llevó al desarrollo de ensayos clínicos para su aprobación en pacientes con obesidad, a dosis mayores que las utilizadas en la DM2. En el momento actual los arGLP-1 autorizados para el tratamiento de la obesidad son liraglutida (3,0 mg/día sc) y semaglutida (2,4 mg/semana sc). El único agonista dual GLP-1/GIP aprobado para la indicación de obesidad es tirzepatida, a las mismas dosis que las autorizadas en DM2 (5-15 mg/semana sc), aunque en nuestro país solo están disponibles actualmente las dosis de 5 y 10 mg.
2. Efectos adversos asociados a los arGLP-1
Numerosos ensayos clínicos y estudios observacionales en vida real muestran que los efectos adversos (EAs) más frecuentes asociados a los arGLP-1 y los agonistas duales son los de naturaleza gastrointestinal (GI), tales como náuseas, vómitos, diarrea y estreñimiento. Su frecuencia en los ensayos clínicos oscila entre el 40 y el 70% de los pacientes tratados. (6) La tabla 1 muestra un resumen de su frecuencia de aparición en ensayos clínicos de fase III en DM2 y obesidad (6,7). Los EAs GI surgen independientemente de la vida media (acción larga/corta) o la vía de administración (subcutánea/oral) del arGLP-1 elegido. Suelen ser transitorios, comienzan típicamente durante el período de aumento de la dosis, generalmente se resuelven poco después de alcanzar la dosis de mantenimiento y, en la mayoría de los casos, son de gravedad leve a moderada y no conducen a la retirada del fármaco. La experiencia con estos fármacos en la práctica clínica real replica estas observaciones.
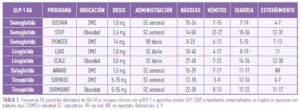
Entre los EAs GI más comunes, las náuseas aparecen sistemáticamente como el evento más frecuente en todos los ensayos clínicos, en probable relación con el retardo transitorio del vaciamiento gástrico en la fase de titulación de dosis y un efecto directo sobre áreas del sistema nervioso central relacionadas con respuestas aversivas y la reducción de la motilidad del tracto GI (1). La prevalencia de los otros EAs GI es menor. En general, la aparición de EAs GI es mayor en aquellos ensayos diseñados para evaluar la eficacia y seguridad de estos fármacos en personas con obesidad, lo que puede atribuirse al hecho de que las dosis son más altas que las utilizadas en los ensayos clínicos en personas con DM2. Los fármacos de acción prolongada se han asociado con menos náuseas y vómitos, pero con más diarrea, lo que podría explicarse por un efecto más sostenido de estos compuestos sobre los receptores intestinales de GLP-1 (6).
Los arGLP-1 enlentecen el vaciamiento de la vesícula biliar estimulado por la colecistoquinina y aumentan la litogenicidad de la bilis al inducir una rápida pérdida de peso y reducir la ingesta de grasa, como se ha observado también en pacientes intervenidos de cirugía bariátrica. Se ha comunicado un mayor número de EAs de la vesícula biliar, entre ellos colelitiasis, colecistitis y obstrucción biliar, en personas con DM2 y obesidad con esta clase terapéutica, aunque su incidencia es muy infrecuente, generalmente por debajo del 3% (1,6). A pesar de la información contenida en la ficha técnica de estos fármacos, múltiples ensayos clínicos y metaanálisis no han demostrado una asociación causal entre los arGLP-1 y el riesgo de pancreatitis aguda (6).
Los EAs GI pueden conducir a la interrupción temporal o permanente del tratamiento con arGLP-1. Aunque las interrupciones permanentes oscilan entre el 3-10% de los pacientes tratados en los ensayos clínicos conforme a la información de las fichas técnicas de los fármacos comercializados en nuestro país, en la práctica clínica real se ha encontrado que el mantenimiento del tratamiento con arGLP-1 a largo plazo es baja, llegando a ser inferior al 36% con algunas moléculas al cabo de un año (8). Este fenómeno se observó incluso antes de los problemas de desabastecimiento de estos fármacos a nivel mundial. La persistencia del tratamiento parece ser más prolongada con los arGLP-1 de administración semanal en comparación con aquellos que requieren inyecciones una vez al día.
La interrupción del tratamiento con arGLP-1 puede conllevar importantes implicaciones clínicas (9). Por ejemplo, en los ensayos clínicos con semaglutida en obesidad, dos tercios del peso perdido durante el tratamiento se recuperó en pocos meses tras la interrupción del fármaco, acompañándose de un deterioro de parámetros cardiometabólicos e inflamatorios como los niveles de glucosa, presión arterial, colesterol o proteína C reactiva. Estudios observacionales sugieren un mayor riesgo CV tras la interrupción del arGLP-1, como sucede con otros fármacos como las estatinas o los inhibidores de SGLT-2 (9). Además, las interrupciones temporales pueden inducir variaciones cíclicas de peso que generen una pérdida de masa muscular y mayor riesgo de sarcopenia.
Un manejo adecuado de los EAs GI puede mejorar la experiencia del paciente durante el tratamiento con arGLP-1 o agonistas duales, previniendo su interrupción temporal o permanente (6), lo que indudablemente tendrá un impacto positivo en la adherencia, la eficacia del tratamiento, los beneficios CV y renales y la calidad de vida de las personas tratadas con estos fármacos. Por ello, resulta esencial que los pacientes y los profesionales de la salud conozcan los procedimientos correctos a seguir para prevenir la aparición de EAs GI o, si ocurren, para mitigar su efecto y mejorar la adherencia al tratamiento.
3. Normas generales para la prevención y tratamiento de los EAs GI
En la tabla 2 se resumen las pautas generales dirigidas a los pacientes para evitar la aparición de EAs GI y reducir su intensidad en aquellos casos en que se desarrollen. Merece la pena dedicar unos minutos a explicar estas recomendaciones al paciente antes de iniciar el tratamiento. En aquellos casos infrecuentes de particular intensidad y/o persistencia de EAs GI, los profesionales sanitarios pueden aplicar las siguientes medidas adicionales (6).

- Respetar la pauta de escalada de dosis reflejada en las fichas técnicas, con el objetivo de ayudar a los pacientes a desarrollar una desensibilización progresiva (taquifilaxia) al retraso excesivo en el vaciamiento gástrico durante el tratamiento.
- Si aparecen EAs GI durante la fase de aumento de dosis, los profesionales sanitarios pueden modificar el programa planificado implementando uno o varios de los siguientes puntos:
- Asegurarse de que el paciente comprende y cumple las pautas sobre hábitos dietéticos.
- Evitar el aumento de dosis mientras persistan los EAs GI.
- Si se experimenta un EA GI al pasar a una dosis más alta, volver a la dosis más baja y mantenerla 2-4 semanas más. Luego, aumentar la dosis gradualmente.
- En caso de persistir limitaciones de tolerabilidad, establecer una dosis menor a la máxima recomendada por la ficha técnica como dosis de mantenimiento.
- En casos graves, suspender el tratamiento temporalmente hasta la resolución de los EAs y luego reanudarlo, bien a una dosis inferior o directamente reiniciar la escalada de dosis desde el inicio.
- Iniciar un procedimiento de diagnóstico diferencial para descartar condiciones subyacentes que causen los síntomas o su exacerbación (por ejemplo, una gastroenteritis intercurrente o una patología gastroesofágica no diagnosticada), Esto es especialmente relevante cuando el paciente ya ha alcanzado la dosis de mantenimiento con buena tolerancia inicial.
- Iniciar un tratamiento sintomático enfocado en el EA GI específico.
- Puede considerarse cambiar a otro arGLP-1/agonista dual o bien a otra ruta de administración, iniciando el nuevo fármaco en su dosis más baja.
4. Tratamiento específico de los EAs GI.
4.1 Náuseas.
Su incidencia es mayor durante las primeras 4-5 semanas de tratamiento. Los síntomas suelen ser moderados y desaparecer tras una media de 8 días. Para aliviar la sintomatología se recomiendan las siguientes medidas (6).
- Revisar con el paciente las recomendaciones sobre hábitos de ingesta y composición de los alimentos.
- Considerar medicación antiemética y/o procinética. Se recomienda utilizar domperidona (10 mg tres veces al día) en lugar de metoclopramida, especialmente en pacientes mayores, para minimizar el riesgo de efectos secundarios extrapiramidales. En caso de que se esté utilizando semaglutida oral, debe transcurrir un período de 30 minutos entre la administración de ambos medicamentos. Si se necesitan medicamentos para mitigar las náuseas durante más de un mes cuando se ha alcanzado la dosis de mantenimiento del fármaco, se debe considerar una reducción de la dosis para que el paciente tolere el medicamento sin necesidad de soporte farmacológico.
4.2 Vómitos.
La frecuencia de vómitos es menor que la descrita para las náuseas y su patrón temporal es similar. Las medidas iniciales no difieren sustancialmente de las ya revisadas. En caso de persistencia anormalmente prolongada o gravedad inesperada, se pueden llevar a cabo acciones adicionales (6).
- Mantener una hidratación adecuada para evitar complicaciones como la depleción de volumen y el fracaso renal agudo, especialmente en ancianos.
- Ingerir pequeñas cantidades de alimentos en comidas más frecuentes.
- Prescribir medicamentos antieméticos y/o procinéticos, siendo de elección la domperidona.
- En caso de síntomas graves de deshidratación o intolerancia oral el paciente debe ser valorado en un servicio de urgencias para descartar otras patologías e iniciar sueroterapia y tratamiento antiemético intravenoso. Se recomienda en estos casos una interrupción temporal o un descenso de dosis del fármaco y vigilancia estrecha del paciente.
4.3 Diarrea.
La diarrea se inicia durante las primeras cuatro semanas de tratamiento, tras las cuales la incidencia disminuye notablemente. Se ha descrito que los síntomas duran una media de tres días. Las siguientes medidas pueden ayudar a resolver o reducir la severidad de la diarrea (6).
- Se debe revisar con los pacientes las recomendaciones dietéticas específicas para mitigar la diarrea.
- En caso de persistencia, considerar la administración de suplementos probióticos y/o antidiarreicos como la loperamida. Los arGLP-1 pueden exacerbar una diarrea preexistente en pacientes tratados con metformina, especialmente si también están tomando omeprazol. En estos casos, puede considerarse una reducción de la dosis de metformina.
- Si todo esto falla, considerar reducir la dosis del fármaco, cambiar vía de administración o iniciar otra molécula a la dosis más baja.
4.4 Estreñimiento.
El estreñimiento ocurre con mayor frecuencia en pacientes con obesidad que con DM2. El inicio puede ser en las primeras 16 semanas de tratamiento, particularmente durante los primeros 28 días, y suele durar más que los otros EAs GI, con una duración media de 47 días. Se recomienda revisar con el paciente los siguientes puntos con el fin de paliar los síntomas de estreñimiento.
- Insistir en incrementar la ingesta de agua, pues los arGLP-1 inducen una reducción de la ingesta hídrica.
- Reeducación del hábito intestinal.
- Aumentar la ingesta de fibra.
- Considerar el uso de laxantes ablandadores de heces.
- En casos graves considerar reducir la dosis del fármaco, cambiar vía de administración o iniciar otra molécula a la dosis más baja.
4.5 EAs relacionados con la vesícula biliar.
Se trata de un EA infrecuente, pero su probabilidad de aparición es mayor en pacientes con antecedentes de pancreatitis o enfermedad de la vesícula biliar. Por lo tanto, se debe tener precaución en pacientes con estos antecedentes.
- Se recomienda no hacer una restricción excesiva de grasa alimentaria, proporcionando una adecuada cantidad de grasas cardiosaludables ricas en ácido oleico y omega 3, con el fin de evitar la hipomotilidad de la vesícula biliar.
- Aunque no hay ensayos clínicos publicados, el ácido ursodesoxicólico (500 mg/día 6 meses) podría administrarse de forma preventiva a pacientes con antecedentes de colelitiasis o aquellos que experimentan una rápida pérdida de peso en las primeras semanas de tratamiento, de forma similar a lo que se hace en pacientes intervenidos de cirugía bariátrica (10).
- En caso de aparición de complicaciones pancreatobiliares, estas deben manejarse de acuerdo con las pautas de cada centro, siendo prudente la suspensión del fármaco hasta la resolución de la causa (colecistectomía, extracción del cálculo biliar).
5.Conclusiones
Los arGLP-1 y los agonistas duales GLP-1/GIP son fármacos altamente eficaces y con un buen perfil de seguridad para el tratamiento de personas con DM2 y obesidad. Se debe informar a los pacientes antes de iniciar el tratamiento para que sean conscientes de que pueden experimentar EAs GI, y que estos probablemente serán de intensidad leve a moderada y transitorios, siempre que se adhieran a las recomendaciones de incremento de dosis de la ficha técnica. También se debe educar a los pacientes para que sigan una serie de pautas dietéticas que los ayudarán a prevenir o, al menos, a mitigar estos EAs. Los profesionales sanitarios deben adaptar de forma flexible el esquema de aumento de dosis ante la aparición de EAs GI y pautar un tratamiento sintomático adecuado en los casos severos y/o persistentes. El objetivo final es que los pacientes mantengan a largo plazo los beneficios cardiometabólicos, renales y de calidad de vida que esta clase terapéutica les proporciona.
Bibliografía
- Drucker DJ. Efficacy and Safety of GLP-1 Medicines for Type 2 Diabetes and Obesity. Diabetes Care. 2024 Nov 1;47(11):1873-1888.
- Karagiannis T, Avgerinos I, Liakos A, Del Prato S, Matthews DR, Tsapas A, Bekiari E. Management of type 2 diabetes with the dual GIP/GLP-1 receptor agonist tirzepatide: a systematic review and meta-analysis. Diabetologia. 2022 Aug;65(8):1251-1261.
- de Mesquita YLL, Pera Calvi I, Reis Marques I, Almeida Cruz S, Padrao EMH, Carvalho PEP, da Silva CHA, Cardoso R, Moura FA, Rafalskiy VV. Efficacy and safety of the dual GIP and GLP-1 receptor agonist tirzepatide for weight loss: a meta-analysis of randomized controlled trials. Int J Obes (Lond). 2023 Oct;47(10):883-892
- Sattar, N.; Lee, M.; Kristensen, S.L.; Branch, K.; Del Prato, S.; Khurmi, N.S.; Lam, C.; Lopes, R.D.; McMurray, J.; Pratley, R.E.; et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. Lancet Diabetes Endocrinol. 2021, 9, 653-662.
- Lincoff AM, Brown-Frandsen K, Colhoun HM, Deanfield J, Emerson SS, Esbjerg S, Hardt-Lindberg S, Hovingh GK, Kahn SE, Kushner RF, Lingvay I, Oral TK, Michelsen MM, Plutzky J, Tornøe CW, Ryan DH; SELECT Trial Investigators. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023 Dec 14;389(24):2221-2232.
- Gorgojo-Martínez JJ, Mezquita-Raya P, Carretero-Gómez J, Castro A, Cebrián-Cuenca A, de Torres-Sánchez A, García-de-Lucas MD, Núñez J, Obaya JC, Soler MJ, Górriz JL, Rubio-Herrera MÁ. Clinical Recommendations to Manage Gastrointestinal Adverse Events in Patients Treated with Glp-1 Receptor Agonists: A Multidisciplinary Expert Consensus. J Clin Med. 2022 Dec 24;12(1):145.
- Ficha técnica Mounjaro EMA 2024. https//:cima.aemps.es/cima/dochtml/ft/1221685014/FT_1221685014.html Consultado el 24 noviembre 2024.
- Gasoyan H, Pfoh ER, Schulte R, Le P, Butsch WS, Rothberg MB. One-Year Weight Reduction With Semaglutide or Liraglutide in Clinical Practice. JAMA Netw Open. 2024 Sep 3;7(9):e2433326
- Khan SS, Ndumele CE, Kazi DS. Discontinuation of Glucagon-Like Peptide-1 Receptor Agonists. JAMA. 2024 Nov 13. doi: 10.1001/jama.2024.22284. Epub ahead of print. PMID: 3953574.
- Al-Huniti M, Alsardia Y, Odeh A, Bdour B, Hassanat R, Aloun A, Sha’ban BW, Nseirat SM. Ursodeoxycholic Acid Prophylaxis and the Reduction of Gallstone Formation After Bariatric Surgery: An Updated Meta-Analysis of Randomized Controlled Trials. Cureus. 2023 Dec 17;15(12):e50.







