Existen múltiples fármacos que pueden provocar prediabetes (preDM), diabetes (DM) o empeorar el control glucémico de pacientes con DM previa. Esto ocurre sobre todo en personas con predisposición genética y con factores ambientales favorecedores concurrentes. Aunque son numerosos los fármacos que potencialmente pueden causar estas alteraciones, esta revisión se centra en 4 grupos farmacológicos: glucocorticoides (GCs), antipsicóticos (AP), antirretrovirales (TAR) e inhibidores de los puntos de control inmunitarios (ICIs). Algunos de ellos causan elevaciones de la glucosa (hiperglucemias) severas, que son transitorias y desaparecen cuando se retiran (ej. GCs). Otros ocasionan DM permanente que puede originar complicaciones metabólicas crónicas a largo plazo si el control metabólico crónico no es el adecuado (ej. GCs, AP, TAR, ICIs).
GLUCOCORTICOIDES (GCs)
Los GCs más comúnmente prescritos (prednisona, prednisolona y metilprednisolona) son de vida media intermedia (duran 12-36 horas). Son pautados de dos formas: a dosis medias-altas durante cortos periodos de tiempo para tratar una gran cantidad de enfermedades inflamatorias y a dosis bajas mantenidas durante largos periodos de tiempo para atenuar la progresión de enfermedades inflamatorias crónicas y prevenir el rechazo de los órganos trasplantados.
La DM inducida por GCs (DMIGC) se define como un aumento anormal en la glucosa plasmática cuando se inicia tratamiento con GCs en individuos, previamente con DM o no1.
¿La DM es un efecto secundario frecuente?
Los GCs pueden causar dos tipos de alteraciones en la glucosa. Cuando se emplean a dosis medias-altas en el hospital, casi la mitad de los pacientes presentarán hiperglucemia2, que puede llegar a ser muy severa, pero que en muchos casos será transitoria y desaparecerá cuando se suspenda el GC. Algunos de estos pacientes, así como algunos de los que reciben dosis menores de GCs durante largos periodos de tiempo, desarrollarán DMIGC. Su prevalencia oscila entre un 2% (en consulta general) y un 32% (en trasplantados o pacientes con artritis reumatoide). Son factores predisponentes para su aparición: los ya conocidos para DM2, el antecedente de diabetes gestacional o de hiperglucemia aguda inducida por GCs, la dosis diaria de GCs y la duración del tratamiento con los mismos. Cuando existe una DM previa, los GCs sistemáticamente empeoran el control glucémico.
¿Por qué se produce?
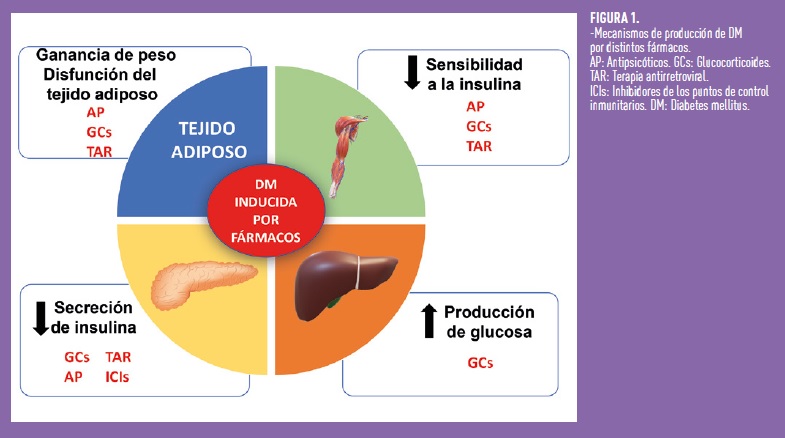
Los GCs alteran la producción de insulina y aumentan la resistencia periférica a la misma3, produciendo fundamentalmente una subida de la glucosa de después de la ingesta (hiperglucemia postprandial). En el hígado estimulan la producción de glucosa (gluconeogénesis) y también aumentan el glucagón (hormona con efecto contrario al de la insulina). En el músculo esquelético disminuyen la captación de glucosa y su almacenamiento en forma de glucógeno. Producen también expansión del tejido adiposo visceral a través de diversos mecanismos, y favorecen, en menor medida, su degradación (lipolisis). Esta lipolisis resulta perjudicial puesto que libera ácidos grasos no esterificados (NEFA), adiponectina, resistina y leptina que ocasionan resistencia y/o disminución de la secreción de la insulina. La exposición crónica a GCs acaba produciendo en las células beta pancreáticas disminución de la producción y secreción de insulina.
¿Cómo se manifiesta?
La hiperglucemia ocurre a las pocas horas de la administración del GCs en sujetos con DM previa y en un tiempo variable en sujetos sin DM previa. Los GCs más usados de vida media intermedia ocasionan hiperglucemia en la segunda parte del día, alcanzándose los valores máximos de glucemia en la merienda y en la cena. Por ello, la determinación de la glucemia predesayuno no es válida para realizar el diagnóstico de DMIGC. Un criterio diagnóstico más útil es la detección en cualquier momento del día de una glucemia plasmática mayor de 200 mg/dl. Se podrían emplear para el diagnóstico también la hemoglobina glicosilada (HbA1c) en tratamientos prolongados con GCs (más de 2 meses) y la fructosamina en tratamientos más cortos.
Los GCs administrados localmente (intra-articulares, epidurales) pueden causar hiperglucemia aguda y/o DMIGC con menor frecuencia que los orales. En el caso de la administración intra-articular, el riesgo variará según el tipo y la dosis del GC y el número de las articulaciones que sean infiltradas.
¿Cómo se maneja?
En pacientes con diabetes en los que se inicia GCs es recomendable aumentar el número de glucemias capilares diarias, prestando especial atención a las glucemias realizadas en la merienda y en la cena. Los usuarios de monitorización continua de glucosa deberán estar igualmente atentos a las lecturas del sensor. El tratamiento variará según la severidad de la hiperglucemia y el GC empleado (duración de efecto y dosis). Si la hiperglucemia es leve se puede emplear metformina para reducir la resistencia periférica a la insulina. Hay publicaciones con resultados positivos empleando: sulfonilureas (SU), inhibidores de la enzima dipeptidil-peptidasa 4 (iDPP4) y agonistas del receptor del péptido Glucagón-like 1 (arGLP-1). Con respecto a las SU, se debe tener en cuenta que pueden producir bajadas de glucosa (hipoglucemias) durante la retirada de los GCs.
LOS GLUCOCORTICOIDES ALTERAN LA PRODUCCIÓN DE INSULINA Y AUMENTAN LA RESISTENCIA PERIFÉRICA A LA MISMA, PRODUCIENDO FUNDAMENTALMENTE UNA SUBIDA DE LA GLUCOSA DE DESPUÉS DE LA INGESTA (HIPERGLUCEMIA POSTPRANDIAL). EN EL HÍGADO ESTIMULAN LA PRODUCCIÓN DE GLUCOSA (GLUCONEOGÉNESIS) Y TAMBIÉN AUMENTAN EL GLUCAGÓN (HORMONA CON EFECTO CONTRARIO AL DE LA INSULINA)
Si la hiperglucemia es importante, el tratamiento recomendado será la insulina. Se empleará una pauta basal-bolo-correctora con ciertas peculiaridades. En la mayoría de casos, en los que se utilizan GCs de vida media intermedia, para adecuarnos al patrón de hiperglucemia que producen, lo más apropiado será administrar una dosis de insulina basal por la mañana, priorizando las insulinas intermedias (ej. NPH) sobre las lentas (ej. glargina U100, detemir) y ultralentas (ej. glargina U300, degludec) para evitar ocasionar hipoglucemias de madrugada y antes del desayuno del día siguiente. Si empleando una única dosis de insulina intermedia antes del desayuno, el paciente sigue llegando con glucemias elevadas a la mañana siguiente, se añadirá una segunda dosis de insulina intermedia antes de la cena, administrándose el 80% de la basal antes del desayuno y el 20% antes de la cena. Además, la pauta insulínica se completará con insulina rápida (ej. lispro, aspart, glulisina) o ultrarrápida (ej. faster aspart) (basal-bolo-correctora). Es de especial importancia el control médico durante los periodos de ajuste (subida, bajada o retirada) de los GCs, para ir modulando el tratamiento insulínico en paralelo al de los GCs, con vistas a evitar que aparezcan hipo/hiperglucemias. El manejo de pacientes con DM1 o con DM2 en tratamiento con insulina, a los que se inicia tratamiento esteroideo es complicado y muchas veces requiere consultar con el servicio de Endocrinología y Nutrición. Será preciso, en la mayoría de los casos, aumentar la dosis de insulina y ajustarla en función del tipo y la dosis del GC, los datos de glucosa capilar/intersticial del paciente y otros factores intercurrentes que pueden surgir durante la hospitalización.
FÁRMACOS ANTIPSICÓTICOS (AP)
Existen dos grandes categorías de AP: los de 1ª generación/típicos (PAP) y los de 2ª generación/atípicos (SAP). Los PAP (clorpromazina, haloperidol…) son antagonistas del receptor dopaminérgico D2 y pueden ocasionar como efectos secundarios movimientos extrapiramidales (temblores…), elevación de la prolactina (salida de leche por las mamas, alteraciones menstruales…) y aumento de peso. Los SAP se desarrollaron para evitar los efectos adversos anteriores. Unos son antagonistas principalmente de los receptores de 5OH-triptamina2c (clozapina, olanzapina, risperidona, quetiapina). Otros son agonistas parciales de los receptores dopaminérgicos D2 y de los receptores de 5OH-triptamina1A (aripiprazol, ziprasidona) que presentan menor riesgo de DM. Si clasificamos a los SAP por el riesgo de ganancia de peso y DM que ocasionan, la clozapina y la olanzapina son los de mayor riesgo, seguidos por la risperidona y la quetiapina y finalmente estarían el aripiprazol y la ziprasidona.
EL MANEJO DE PACIENTES CON DM1 O CON DM2 EN TRATAMIENTO CON INSULINA, A LOS QUE SE INICIA TRATAMIENTO ESTEROIDEO ES COMPLICADO Y MUCHAS VECES REQUIERE CONSULTAR CON EL SERVICIO DE ENDOCRINOLOGÍA Y NUTRICIÓN
¿La DM es un efecto secundario frecuente?
Los AP multiplican por dos el riesgo de ganar peso de forma significativa (>7%) y por dos o tres veces la prevalencia de DM comparado con individuos de la misma edad y sexo de la población general. La prevalencia de DM entre usuarios de AP llega al 10%4.
¿Por qué se produce?
Los AP incrementan el apetito. Al tener un efecto antagónico sobre los receptores de 5OH-triptamina2c impiden que la serotonina estimule las neuronas encargadas de la saciedad. La inhibición de los receptores de la Histamina H1 también contribuye. Por otro lado, los AP reducen el consumo energético por su efecto sedante, que ocasiona disminución de los movimientos voluntarios, y por alteración en la expresión de la UCP-1 (proteína desacoplante 1) en el tejido adiposo marrón. El riesgo de DM está estrechamente relacionado con el grado de ganancia de peso. Los AP alteran: la señalización periférica y la secreción de la insulina, la producción endógena de glucosa y la captación de glucosa por las células. En algunos individuos pueden ocasionar un déficit abrupto en la secreción de insulina ya sea por una disrupción aguda en la secreción de insulina dependiente de glucosa o por efecto citotóxico directo sobre las células beta pancreáticas, lo cual puede originar una CAD.
¿Cómo se manifiesta?
En las primeras semanas tras iniciar los AP se observa una rápida ganancia de peso, que luego continúa a menor velocidad. Se objetiva también un aumento de la glucemia, que comienza incluso antes que la ganancia de peso. Se han descrito casos de CAD, como se ha comentado anteriormente5.
¿Cómo se maneja?
Se recomendará seguir un estilo de vida saludable, para minimizar el riesgo de aparición de DM, especialmente si existe alto riesgo de base. En estos sujetos de riesgo se elegirán AP con menor riesgo de efectos metabólicos indeseados como son el aripiprazol y la ziprasidona o incluso los PAP. Se monitorizará la glucemia en ayunas durante las primeras 12 semanas de tratamiento y después analíticamente una vez al año si no se desarrollara DM desde el principio. Si el paciente comienza con DM y tiene prescritos AP con alto riesgo de causar alteraciones metabólicas, se considerará, si desde el punto de vista psiquiátrico es posible, el cambio a AP con menor efecto deletéreo a nivel metabólico. En cuanto al tratamiento de la DM, la metformina es considerada fármaco de primera elección, debiendo priorizar después aquellos fármacos que ocasionen pérdida de peso (arGLP-1, iSGLT2). Si existiera un déficit de insulina severo, se precisará tratamiento insulínico.
TERAPIA ANTIRRETROVIRAL (TAR)
TAR es la combinación de varios fármacos antirretrovirales que se emplea para reducir la velocidad a la que el virus de inmunodeficiencia humano (VIH) hace copias de sí mismo (se multiplica) en el organismo. Existen 4 clases de fármacos antirretrovirales:
- Inhibidores de la retrotranscriptasa análogos de nucleósido (NRTIs) (zidovudina, estavudina, didanosina, lamivudina, abacavir, tenofovir, emtricitabina).
- Inhibidores de la retrotranscriptasa no análogos de nucleósido (NNRTIs) (efavirenz, nevirapina, etravirina, nilpivirina, doravirina.
- Inhibidores de la proteasa (PIs) (indinavir, ritonavir, nelfinavir, lopinavir/ritonavir, atazanavir/ritonavir, darunavir/ritonavir).
- Inhibidores de transferencia de la cadena de integrasa (INSTIs) (raltegravir, dolutegravir, elvitegravir, bictegravir).
LA DIABETES GENERALMENTE ES ASINTOMÁTICA Y SE DETECTA EN LAS ANALÍTICAS DE SANGRE REALIZADAS PARA EL CONTROL DEL TRATAMIENTO DEL VIH
¿La DM es un efecto secundario frecuente?
La aparición de nuevas clases de TAR y de nuevas moléculas dentro de cada clase no sólo ha permitido aumentar su efectividad en el tratamiento del VIH sino también ha posibilitado disminuir los efectos metabólicos desfavorables, entre ellos la DM, que presentaban los fármacos iniciales. En la actualidad la incidencia acumulada media de DM asociada a TAR es de 4.9%. Es mayor en Estados Unidos (EE. UU) (19.1/1000 personas año de seguimiento (PYFU)) que en Europa (8/1000 PYFU), probablemente en relación con la mayor prevalencia de obesidad en EE. UU6. En los países en vías de desarrollo, en los que se siguen empleando fármacos con elevada toxicidad, como la estavudina, la zidavudina o el indinavir, la incidencia de DM asociada a TAR es de 13.2/1000 PYFU7.
¿Por qué se produce?
Muchos TAR, especialmente los más antiguos (estavudina, zidavudina, indinavir), ocasionan diferentes grados de atrofia de la grasa periférica con acúmulo de la misma a nivel central (adiposidad visceral). Esto induce resistencia a la insulina, que es el mecanismo patogénico fundamental de la DM inducida por estos fármacos. Los PIs también pueden alterar la función de las células beta pancreáticas.
¿Cómo se manifiesta?
La DM generalmente es asintomática y se detecta en las analíticas de sangre realizadas para el control del tratamiento del VIH. Son factores de riesgo para desarrollar DM asociada a TAR: edad avanzada, raza negra o hispana, sobrepeso u obesidad, adiposidad central, lipoatrofia o lipohipertrofia asociadas a TAR y fármacos antirretrovirales específicos.
¿Cómo se maneja?
Es esencial optimizar las medidas higiénico-dietéticas para lograr el control de los factores de riesgo cardiovascular de estos pacientes y de este modo minimizar la aparición de DM. Es también importante detectar los nuevos casos de DM precozmente para iniciar medidas dietéticas y farmacológicas lo antes posible. Se deben escoger los fármacos teniendo en cuenta sus ventajas e inconvenientes y las preferencias de los pacientes. La metformina es el fármaco de primera elección y, dada la elevada prevalencia de sobrepeso y obesidad que tienen estos pacientes, se priorizarán después los fármacos que tengan efecto beneficioso (iSGLT2, arGLP-1) o al menos neutro (iDPP4) en el peso8.
INHIBIDORES DE LOS PUNTOS DE CONTROL INMUNITARIOS (ICIs)
La inmunoterapia ha supuesto un gran avance en el tratamiento del cáncer. Los ICIs son unos anticuerpos monoclonales que potencian la activación del sistema inmune, ayudando a contrarrestar la inmunosupresión inducida por el tumor. Existen tres grupos de ICIs:
- inbibidores del antígeno 4 asociado a linfocitos T citotóxicos (anti CTLA-4) (Ipilimumab).
- inhibidores de la molécula de muerte programada 1 (anti PD-1) (pembrolizumab, nivolumab).
- inhibidores del ligando de la molécula de muerte programada 1 (anti PDL-1) (atezolizumab, avelumab, durvalumab).
Como efecto indeseado, estos fármacos pueden inducir patologías autoinmunes que afecten a múltiples órganos y sistemas, entre ellos al sistema endocrinológico, ocasionando DM.
¿La DM es un efecto secundario frecuente?
Si bien es un efecto secundario infrecuente, en un metanálisis9 que incluyó a 24.596 individuos tratados con ICIs, el riesgo de hiperglucemia severa aumentaba 2.41 veces, el de DM 3.54 veces y el de DM1 6.60 veces. Los anti PD-1 y anti PDL-1 son los más frecuentemente asociados, correspondiendo a los anti CTLA-4 solo el 4.2% de los casos10.
¿Por qué se produce?
La causa fundamental es un ataque del sistema inmunológico contra las células de los islotes pancreáticos (cip), que induce la muerte de las células beta y ocasiona deficiencia de insulina. No obstante, solo la mitad de los individuos afectos tienen algún anticuerpo positivo, siendo los más frecuentes los antiGAD65. El estudio histológico ha permitido demostrar en algún caso islotes pancreáticos infiltrados por linfocitos T. La existencia previa al inicio de los ICIs de anticuerpos contras las cip (sobre todo antiGAD65) y haplotipos que predispongan a DM1 (ej, DR4-DQ4) aumentaría el riesgo de desarrollar DM.
¿Cómo se manifiesta?
La DM puede aparecer entre varios días y varios meses después del inicio de los ICIs y es irreversible. Suelen presentarse como una DM1, pero con un debut más tardío (60 años) y con predominio en varones. En raros casos se presentan como una DM2 o como empeoramiento de una prediabetes previa. La forma de debut es variable. Puede aparecer como una hiperglucemia detectada en analítica de sangre sin síntomas, como hiperglucemia con síntomas cardinales de DM (sed, aumento de la orina) o como una CAD.
¿Cómo se maneja?
Antes de iniciar los ICIs, el paciente debe ser informado del riesgo potencial de desarrollar DM. Es esencial que sea educado en el reconocimiento de los signos y síntomas de la hiperglucemia y la CAD con vistas a que pueda buscar atención médica lo antes posible, si fuera preciso. El manejo de la DM, dependerá del grado de hiperglucemia y de la presencia/ausencia de CAD. En todos los casos, excepto si existen una CAD, se mantendrán los ICIs. Si existe una CAD se suspenderán transitoriamente hasta que se controle esta y luego se puede considerar reiniciarlos con monitorización estrecha. Si la hiperglucemia es moderada-severa se comenzará el tratamiento con insulina, que deberá mantenerse de por vida.
Conclusiones
La hiperglucemia inducida por fármacos es un problema creciente. Los mecanismos por los que ocurre son múltiples, en general poco conocidos y varían dependiendo de la clase farmacológica y de las dosis del medicamento empleadas. A pesar del riesgo potencial de hiperglucemia que presentan las 4 clases farmacológicas aquí expuestas, los beneficios que aportan superan con mucho los riesgos de mantenerlas. Se deberá optar, cuando sea posible, por aquellos fármacos que menor afectación metabólica produzcan (especialmente si existe alto riesgo de DM). El tratamiento de la DM debe ser individualizado. Ocupan un papel destacado los fármacos hipoglucemiantes modernos que promueven la pérdida de peso. En aquellos casos que cursen con hiperglucemia severa y por supuesto en los casos de CAD, será preciso instaurar tratamiento insulínico.
Bibliografía
- Suh S, Park MK. Glucocorticoid-induced diabetes mellitus: an important but overlooked problem. Endocrinol Metab (Seoul). 2017; 32(2):180–189.
- Radhakutty A, Burt MG. Management of endocrine disease: critical review of the evidence underlying management of glucocorticoid-induced hyperglycemia. Eur J Endocrinol. 2018;179(4): R207–R218.
- Fève B, Scheen AJ. When therapeutic drugs lead to Diabetes. Diabetologia. 2022; 65:751-762.
- Barton BB, Segger F, Fischer K, Obermeier M, Musil R. Update on weight-gain caused by antipsychotics: a systematic review and meta-analysis. Expert Opin Drug Saf. 2020;19(3):295–314.
- Polcwiartek C, Vang T, Bruhn CH, Hashemi N, Rosenzweig M, Nielsen J. Diabetic ketoacidosis in patients exposed to anti- psychotics: a systematic literature review and analysis of Danish adverse drug event reports. Psychopharmacology. 2016;233(21–22): 3663–3672.
- Nansseu JR, Bigna JJ, Kaze AD, Noubiap JJ. Incidence and risk factors for diabetes and diabetes mellitus among HIV-infected adults on antiretroviral therapy: a systematic review and meta-anal- ysis. Epidemiology.2018; 29(3):431–441.
- Karamchand S, Leisegang R, Schomaker M, Maartens G, Walters L, Hislop M, et al. Risk factors for incident diabetes in a cohort taking first-line nonnucleoside reverse transcriptase inhibitor-based antiretroviral therapy. Medicine (Baltimore).2016; 95(9): e2844.
- Monroe AK, Glesby MJ, Brown TT. Diagnosing and manag- ing diabetes in HIV-infected patients: current concepts. Clin Infect Dis. 2015; 60(3):453–462.
- Lu J, Yang J, Liang Y, Meng H, Zhao J, Zhang X. Incidence of immune checkpoint inhibitor-associated diabetes: a meta- analysis of randomized controlled studies. Front Pharmacol. 2019; 10: 1453.
- Wright JJ, Salem JE, Johnson DB, Stamatouli A,Thomas JW, Herold KC, et al. Increased reporting of immune checkpoint inhibitor-associated diabetes. Diab Care. 2018. 41(12): e150–e151.