Los fármacos antipsicóticos son el tratamiento de elección para la esquizofrenia y otros desórdenes psiquiátricos incluidos el trastorno bipolar, la demencia o la irritabilidad relacionada con el autismo. Desde el uso clínico en 1952 del primer antipsicótico, la clorpromazina, sintetizada originalmente como un complemento anestésico, la farmacoterapia ha sido el tratamiento principal para los trastornos psicóticos. La eficacia clínica de la clorpromazina para el tratamiento de la esquizofrenia propició la síntesis de nuevos derivados dando lugar a los fármacos antipsicóticos de primera generación (FAPG) como la flufenazina y el haloperidol.
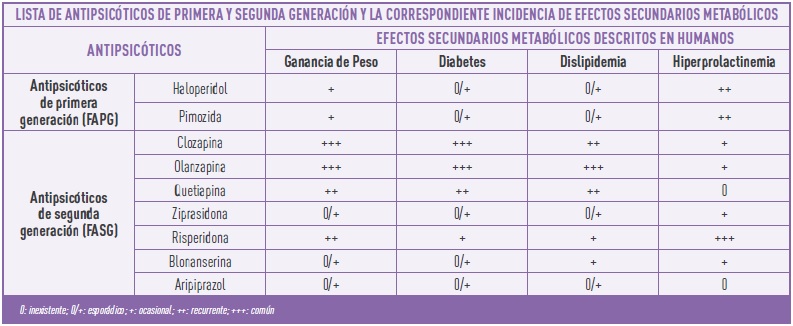
Estos fármacos son antagonistas del receptor dopaminérgico D2. Sin embargo, muchos pacientes en tratamiento desarrollaban efectos secundarios extrapiramidales y trastornos graves del movimiento como parkisonismo, discinesia (movimientos involuntarios erráticos), y acatisia (movimientos involuntarios de piernas). Estos síntomas neurológicos impulsaron el desarrollo de nuevos compuestos conocidos como antipsicóticos de segunda generación (FASG) con menores efectos neurológicos adversos. El primer FASG que se utilizó en clínica fue la clozapina a mediados de la década de 1970, seguido por la risperidona, olanzapina, ziprasidona, quetiapina, amisulprida, sertindol, lurasidona, paliperidona, iloperidona, asenapina y, más recientemente, el aripiprazol que fue aprobado en 2002. A diferencia de los FAPG, los FASG ejercen su acción interactuando con una gama más amplia de receptores, incluido el receptor de serotonina 5-HT1A que se ha relacionado con un menor deterioro cognitivo, una disminución de los síntomas extrapiramidales y una mayor tolerabilidad en los pacientes, por lo que los FASG se prescriben ampliamente como primera línea de tratamiento para la esquizofrenia. Sin embargo, numerosos estudios clínicos han puesto en evidencia una amplia variedad de alteraciones metabólicas en una proporción relevante de pacientes tratados con FASG como un aumento anormal de peso corporal, hiperglucemia y dislipidemia, con una mayor susceptibilidad en las mujeres. Estos efectos secundarios, incluidos en la tabla 1, sugieren que el uso de FASG produce efectos indirectos en diferentes tejidos y sistemas periféricos entre los que se incluyen el páncreas, el tejido adiposo, el hígado y las células inmunes.
En un reciente trabajo colaborativo de CIBERDEM hemos investigado los efectos de dos FASG con distinta estructura química, la olanzapina y el aripiprazol, sobre la plasticidad de los islotes pancreáticos y la funcionalidad de las células beta. Los resultados mostraron que ratones hembra tratados durante 6 meses con olanzapina o aripiprazol por vía oral, que es la vía de elección en la clínica, manifestaron alteraciones metabólicas entre las que se encuentran una mayor ganancia de peso, intolerancia a la glucosa y disminución en la secreción de insulina. Sin embargo, un análisis más detallado reveló que los mecanismos responsables de estas alteraciones fueron específicos para cada fármaco.
Por un lado, los efectos de la olanzapina en el páncreas, que se manifestaban por un aumento del tamaño de los islotes, una hiperinsulinemia y a nivel molecular por un estrés del retículo endoplásmico en las células beta, fueron consecuencia de su mayor efecto orexigénico (incremento del apetito) y obesogénico (sobrepeso u obesidad). A pesar de que ambos FASG promovieron un aumento del peso corporal y alteraron la funcionalidad de las células beta provocando intolerancia a la glucosa, el aripiprazol tuvo un efecto deletéreo más potente sobre las alteraciones metabólicas que se correlacionaba con un aumento de la síntesis de serotonina en los islotes pancreáticos. Este efecto estaba asociado con un aumento de la expresión de[I1] la triptófano hidroxilasa 1 (TPH1), enzima limitante de la síntesis de este neurotransmisor. A nivel molecular se observó que la hipertrofia de las células beta y la mayor masa de estas concurrían con una mayor activación de la vía de señalización mTORC1/S6. Además, los estudios ex vivo en islotes tratados con aripiprazol demostraron, por un lado, que la inhibición de la secreción de insulina inducida por el aripiprazol era debida a una reducción de la entrada de calcio en las células beta y, por otro lado, que los defectos en la secreción de insulina se prevenían con el co-tratamiento con un inhibidor de la TPH1.
En resumen, en este estudio se han identificado alteraciones en la plasticidad de los islotes pancreáticos y en la secreción de insulina en ratones hembra tratados con olanzapina y aripiprazol con importantes implicaciones traslacionales. En el caso del aripiprazol es importante destacar que los resultados apuntan a que el uso de inhibidores específicos de la TPH1 que no atraviesen la barrera hematoencefálica podría evitar el desbalance del sistema serotoninérgico en el páncreas sin alterar los niveles de serotonina en el cerebro.
Entre los efectos secundarios de los FASG que en la clínica se administran por vía oral, la hiperfagia (aumento del apetito) es la causa principal del aumento de peso que se produce sobre todo en las primeras fases del tratamiento. Sin embargo, tras su administración a largo plazo, cuando la ingesta de alimentos se normaliza, la reducción en el gasto de energía debida a una termogénesis defectuosa del tejido adiposo pardo o marrón (TAM) parece ser la causa responsable del aumento de peso corporal. El TAM es abundante en mitocondrias enriquecidas en la proteína desacoplante-1 (UCP-1) en la membrana interna, lo que permite la disipación de la energía química en forma de calor al desacoplar la oxidación de los ácidos grasos de la síntesis de ATP. En los humanos, el TAM se ha identificado principalmente en el área inferior del cuello. Además, la posibilidad de reclutar células adiposas “beige” con un alto potencial termogénico dentro de los depósitos de tejido adiposo blanco (TAB) subcutáneo ha puesto en evidencia nuevas estrategias para combatir la obesidad y sus comorbilidades asociadas.
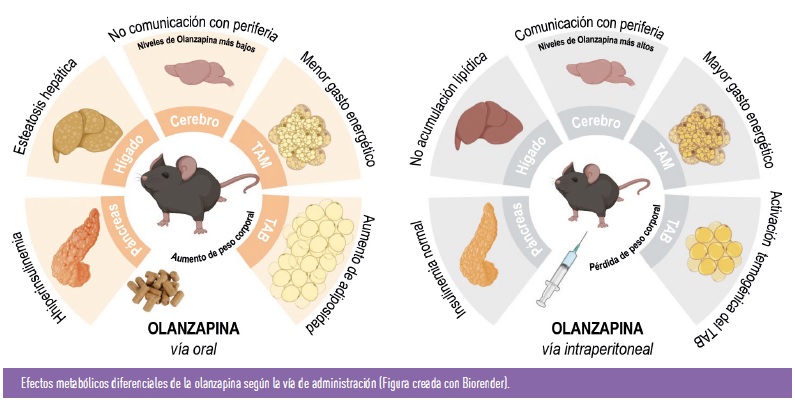
Tal como se ha mencionado, la olanzapina, a pesar de su alta eficacia en el tratamiento de la esquizofrenia y otras enfermedades psiquiátricas con sintomatología psicótica, presenta un efecto adverso altamente obesogénico asociado con alteraciones metabólicas severas como la hiperglucemia, dislipidemia y esteatosis hepática. Estos efectos se han encontrado en pacientes y roedores cuando este fármaco es administrado por vía oral o intramuscular. Sin embargo, hay menos evidencias de los efectos adversos de la olanzapina en el balance energético cuando se administra por vía intraperitoneal. En este sentido, dos estudios preclínicos recientes de nuestro laboratorio han abordado este aspecto, mostrando como los efectos adversos a nivel metabólico de la olanzapina dependen de la vía de administración. Así, ratones macho que recibieron olanzapina suplementada en la dieta presentaron, al igual que las hembras, hiperfagia, ganancia de peso y disminución del gasto energético. Sin embargo, cuando se administraba una dosis equivalente de este FASG por vía intraperitoneal, los ratones perdieron peso, efecto asociado a un aumento del gasto energético. El análisis del TAM y del TAB subcutáneo, conocido como TAB beige, reveló que ambos depósitos grasos presentaban características histológicas de activación termogénica. Además, en los ratones tratados por vía intraperitoneal se producía un aumento de la temperatura de la zona del TAM interescapular y una mayor inervación simpática del TAB beige. A nivel molecular, se encontró una disminución de la fosforilación de la proteína quinasa dependiente de AMP (AMPK) en el hipotálamo, que era paralela a un aumento de los niveles de la UCP-1 en el TAM y TAB beige. Estos cambios moleculares también se observaron en ratones que recibieron una inyección de olanzapina directamente en el hipotálamo, lo que sugería que la activación del gasto energético era consecuencia de una comunicación entre el hipotálamo y los tejidos adiposos termogénicos de manera similar al efecto previamente descrito para las hormonas tiroideas. Por el contrario, este eje hipotálamo-TAM/TAB beige no se modulaba en los ratones que recibieron dosis equivalentes de olanzapina por vía oral.
Con el fin de encontrar el efecto diferencial entre ambos abordajes terapéuticos, se determinaron los niveles de olanzapina en plasma, así como los que alcanzaban el hipotálamo tras la administración de una dosis única por vía intraperitoneal u oral (en este caso mediante sonda gástrica). Los resultados mostraron un pico del fármaco en plasma e hipotálamo 2.5 veces mayor en los ratones inyectados por vía intraperitoneal, sugiriendo que los niveles de olanzapina en el hipotálamo podrían ser determinantes para modular la fosforilación de AMPK en esta región del cerebro y así activar los depósitos grasos termogénicos.
En conclusión, este estudio que incluía diferentes abordajes genéticos ha puesto de manifiesto que la modulación a la baja de la AMPK, que ocurre cuando se sobrepasa un umbral de olanzapina en el hipotálamo, activa la termogénesis evitando así el aumento de peso en ratones macho tratados con este FASG por vía intraperitoneal.
DESDE EL USO CLÍNICO EN 1952 DEL PRIMER ANTIPSICÓTICO, LA CLORPROMAZINA, SINTETIZADA ORIGINALMENTE COMO UN COMPLEMENTO ANESTÉSICO, LA FARMACOTERAPIA HA SIDO EL TRATAMIENTO PRINCIPAL PARA LOS TRASTORNOS PSICÓTICOS. LA EFICACIA CLÍNICA DE LA CLORPROMAZINA PARA EL TRATAMIENTO DE LA ESQUIZOFRENIA PROPICIÓ LA SÍNTESIS DE NUEVOS DERIVADOS DANDO LUGAR A LOS FÁRMACOS ANTIPSICÓTICOS DE PRIMERA GENERACIÓN (FAPG) COMO LA FLUFENAZINA Y EL HALOPERIDOL
Por otra parte, el hígado es un órgano clave en el control de la homeostasis glucídica y lipídica cuya funcionalidad está alterada en estados de obesidad. Por ello, en otro estudio analizamos en detalle los cambios metabólicos inducidos por la olanzapina en este órgano tras el tratamiento de los ratones por vía oral o intraperitoneal. A nivel molecular, los resultados de este trabajo mostraron que los ratones que recibieron olanzapina por vía intraperitoneal presentaron un inesperado aumento del programa transcripcional que regula la expresión de la enzima lipogénica ácido graso sintasa (FAS). Sin embargo, los ratones tratados no presentaron un aumento de los niveles de lípidos intrahepáticos ni desarrollaron hepatoesteatosis. Una posible explicación a estos resultados, aparentemente opuestos, se sustenta en que en los animales tratados se produce un reajuste metabólico en el hígado mediante la activación de la AMPK que favorece el catabolismo de los ácidos grasos, contrarrestando así el déficit energético asociado a la elevación de FAS y la subsecuente síntesis de ácidos grasos. Además, experimentos realizados en hepatocitos en cultivo y en ratones en los cuales se seccionó el nervio vago indicaron que este aumento de los niveles de FAS no era debido a un efecto directo de la olanzapina en el hígado, sino que era consecuencia de la comunicación hipotálamo-hígado que también dependía de los niveles del fármaco que llegan a esta región del cerebro. Por el contrario, los ratones tratados con olanzapina por vía oral no presentaron estos cambios moleculares asociados a la reprogramación metabólica del hígado, sugiriendo que la esteatosis observada en estos animales es una consecuencia de la hiperfagia asociada al tratamiento oral. En conjunto, los hallazgos de estos estudios apuntan a un efecto diferencial dependiente de la vía de administración de la olanzapina asociado a los niveles del fármaco que se alcanzan en el hipotálamo, siendo más elevados tras el tratamiento por vía intraperitoneal.
La traslación de los resultados de estos estudios al ámbito clínico se sustenta en un estudio reciente que reporta la seguridad de la administración intravenosa de la olanzapina en pacientes, incluso después de múltiples dosis, apuntando el posible beneficio terapéutico del cambio de la vía de administración de este fármaco antipsicótico de manera personalizada.
Bibliografía
- V. Ferreira, D. Grajales, A.M. Valverde, Adipose tissue as a target for second-generation (atypical) antipsychotics: A molecular view, Biochim Biophys Acta Mol Cell Biol Lipids, 1865 (2020) 158534.
- D. Grajales, V. Ferreira, A.M. Valverde, Second-Generation Antipsychotics and Dysregulation of Glucose Metabolism: Beyond Weight Gain, Cells, 8 (2019).
- S. Leucht, A. Cipriani, L. Spineli, D. Mavridis, D. Orey, F. Richter, M. et al., Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: a multiple-treatments meta-analysis, Lancet, 382 (2013) 951-962.
- Grajales D, Vázquez P, Ruíz-Rosario M, Tudurí E, Mirasierra M, Ferreira V, et al. The second-generation antipsychotic drug aripiprazole modulates the serotonergic system in pancreatic islets and induces beta cell dysfunction in female mice. Diabetologia. 2022 Mar;65(3):490-505.
- Grajales D, Vázquez P, Alén R, Hitos AB, Valverde ÁM. Attenuation of Olanzapine-Induced Endoplasmic Reticulum Stress Improves Insulin Secretion in Pancreatic Beta Cells. Metabolites. 2022 May 16;12(5):443.
- V. Ferreira, C. Folgueira, M. Guillen, P. Zubiaur, M. Navares, A. Sarsenbayeva, P. et al. Modulation of hypothalamic AMPK phosphorylation by olanzapine controls energy balance and body weight, Metabolism, 137 (2022) 155335.
- Ferreira V, Folgueira C, García-Altares M, Guillén M, Ruíz-Rosario M, DiNunzio G, et al. Hypothalamic JNK1-hepatic fatty acid synthase axis mediates a metabolic rewiring that prevents hepatic steatosis in male mice treated with olanzapine via intraperitoneal: Additional effects of PTP1B inhibition. Redox Biol. 2023 Jul;63:102741.
- K.J. Burghardt, B. Seyoum, A. Mallisho, P.R. Burghardt, R.A. Kowluru, Z. Yi, Atypical antipsychotics, insulin resistance and weight; a meta-analysis of healthy volunteer studies, Prog Neuropsychopharmacol Biol Psychiatry, 83 (2018) 55-63.
- J. Ferno, K.M. Ersland, I.H. Duus, I. Gonzalez-Garcia, K.O. Fossan, R.K. Berge, V.M. et al. Olanzapine depot exposure in male rats: Dose-dependent lipogenic effects without concomitant weight gain, Eur Neuropsychopharmacol, 25 (2015) 923-932.
- N. Martinez-Sanchez, P. Seoane-Collazo, C. Contreras, L. Varela, J. Villarroya, E. Rial-Pensado, et al. Hypothalamic AMPK-ER Stress-JNK1 Axis Mediates the Central Actions of Thyroid Hormones on Energy Balance, Cell Metab, 26 (2017) 212-229 e212.







