La composición de microorganismos que forman parte de nuestro tubo digestivo constituye nuestra microbiota intestinal. El papel que tiene esta microbiota se ha definido como inmunomodulador, es decir, que puede controlar las características de la respuesta inmunitaria en esa localización.
Pero ¿cómo contribuye la microbiota intestinal al desarrollo de enfermedades como la diabetes tipo 2 (DM2) o la obesidad, y qué papel tiene el sistema inmunitario?
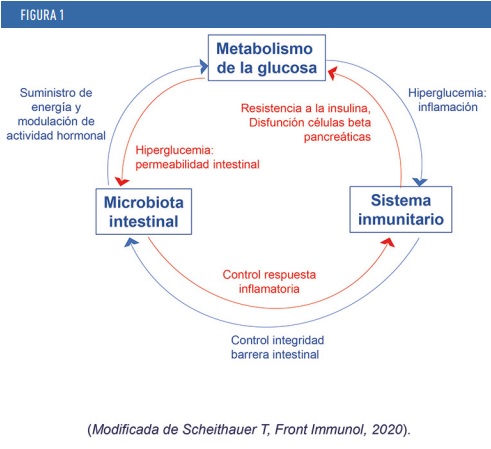
Los mecanismos de acción de la microbiota intestinal están en proceso de estudio, pero se propone un mecanismo triple en el que también está implicado nuestro sistema inmunitario (figura 1). Estos tres componentes son la microbiota intestinal, el sistema inmunitario y el metabolismo de la glucosa. La actividad de cada uno de ellos tiene un impacto sobre los otros dos de forma recíproca, de modo que:
- La microbiota influye en el metabolismo de la glucosa por la producción de diferentes metabolitos inducidos por estos microorganismos. Cuando se detectan niveles altos de glucosa, hiperglucemia, se produce un aumento de la permeabilidad en el intestino y, por tanto, un paso de bacterias completas o de componentes de éstas hacia la circulación (translocación bacteriana). Además, aunque en condiciones normales bacterias y sistema inmunitario están en equilibrio, cuando dichas bacterias traspasan las barreras intestinales y translocan inducen una respuesta inflamatoria de activación del sistema inmunitario.
- El sistema inmunitario ayuda a mantener la integridad intestinal y así evita que las bacterias atraviesen la barrera. Como hemos comentado, si hay alteración y paso de bacterias, se producirá una respuesta inflamatoria que conllevará una alteración de distintos tejidos, con posibles consecuencias como inducción de resistencia a la insulina, disfunción de las células beta pancreáticas, o desarrollo de enfermedad del hígado graso.
- El metabolismo de la glucosa puede inducir una respuesta alterada por parte de nuestro sistema inmunitario a través de la interacción de vías metabólicas e inflamatorias (inmunometabolismo).
LOS MECANISMOS DE ACCIÓN DE LA MICROBIOTA INTESTINAL ESTÁN EN PROCESO DE ESTUDIO, PERO SE PROPONE UN MECANISMO TRIPLE EN EL QUE TAMBIÉN ESTÁ IMPLICADO NUESTRO SISTEMA INMUNITARIO. ESTOS TRES COMPONENTES SON LA MICROBIOTA INTESTINAL, EL SISTEMA INMUNITARIO Y EL METABOLISMO DE LA GLUCOSA. LA ACTIVIDAD DE CADA UNO DE ELLOS TIENE UN IMPACTO SOBRE LOS OTROS DOS DE FORMA RECÍPROCA
Inflamación y diabetes tipo 2
La recientemente descrita como “inflamación metabólica de bajo grado” o metainflamación contribuye al desarrollo de resistencia a la insulina y progresión de la DM2. Esta inflamación se caracteriza por la presencia en circulación de moléculas con carácter inflamatorio que tienen efectos negativos en nuestro metabolismo, incluso una respuesta alterada a la infección por virus respiratorios en personas con patología diabética y/u obesidad.
Las moléculas que regulan esta respuesta inflamatoria están producidas por células del sistema inmunitario- los macrófagos-, y forman parte de la familia de citocinas, destacando entre ellas las interleucinas (IL), como la IL-1, de carácter proinflamatorio o las quimiocinas, que participan en el reclutamiento de células inmunitarias a los tejidos como el factor MCP-1.
¿Qué evidencias tenemos en relación con la DM-2?
La investigación nos aporta datos concretos sobre el papel de estas proteínas en el desarrollo de la enfermedad. Como ejemplos analizados de estas interleucinas podemos considerar IL-6, IL-1beta, el factor TNF-alfa o el nombrado MCP-1. Por un lado, IL-6 se encuentra elevada en páncreas de ratones obesos y se asocia con la expansión de células alfa pancreáticas, hecho que se observa en muestras histológicas de pacientes con DM-2. Dado que en este tejido también se observan macrófagos inflamatorios, su producción, así como la de IL-1beta se asocian a dicho tipo celular. De este modo, y aunque niveles bajos de IL-1beta pueden ser beneficiosos promoviendo proliferación de células beta pancreáticas, niveles crónicos elevados pueden tener el efecto contrario. El factor TNF-alfa también se encuentra elevado en pacientes con DM2 y obesidad. La fuente principal de este es la población de macrófagos de tejido adiposo. La neutralización de TNF con anticuerpos en ratas mejora la resistencia a insulina, así como estudios sobre la pérdida de peso indican que se reducen los niveles de dicho factor, favoreciendo de nuevo la captación regular de glucosa. Por último, MCP-1 es producido por células beta pancreáticas, y a través de experimentos con aumento inducido en su producción en modelos animales se observa que provoca la entrada de macrófagos productores de otras citocinas y la diabetes espontánea en los animales.
¿Cómo se relaciona esta respuesta inflamatoria con la microbiota intestinal en DM2?
La microbiota intestinal ha de estar en equilibrio constante con el sistema inmunitario dado que nuestra relación con estos microorganismos es de mutualismo. Su papel es básico en la digestión y producción de metabolitos a partir de alimentos propios de nuestra ingesta diaria. Por ejemplo, las bacterias intestinales metabolizan la fibra alimentaria y generan ácidos grasos de cadena corta (SCFAs) como acetato, propionato y butirato, que son esenciales para mantener el ambiente antiinflamatorio del sistema inmunitario en el intestino. De hecho, se ha observado que modelos de ratón libres de bacterias intestinales tienen un sistema inmunitario subdesarrollado a nivel intestinal, con baja producción de anticuerpos y tamaño reducido de órganos linfoides como bazo y ganglios linfáticos mesentéricos. Cuando en estos animales se reintroduce la población bacteriana, se reestablece la función del sistema inmunitario y se entabla una dinámica de interacción microbiota-inmunidad. Es por esto que el papel inmunomodulador de la microbiota intestinal es relevante y de interés en el contexto de la metainflamación y su relación con DM2. En este sentido, se sabe que pacientes con DM2 tienen disbiosis intestinal, es decir, una microbiota intestinal alterada, con poblaciones bacterianas atípicas expandidas y poblaciones necesarias reducidas. Se ha descrito la presencia de bacterias proinflamatorias como, por ejemplo, Escherichia coli en un porcentaje más alto que de bacterias antiinflamatorias productoras del SCFA butirato como son Faecalibacterium prausnitzii o Roseburia intestinalis, en pacientes con DM2. De hecho, estudios realizados de transferencia de microbiota intestinal (y sus productos) de personas sanas, que contenían estas dos especies bacterianas, a pacientes con enfermedad metabólica, mejoró y redujo la resistencia a insulina. Con estas observaciones es plausible que el elevado número de bacterias de perfil proinflamatorio en DM2 sea en parte responsable de la metainflamación observada en enfermedades metabólicas.
¿Cómo llegan las bacterias intestinales o sus productos a la circulación sistémica y a tener una influencia tan importante sobre la respuesta inflamatoria?
Se sabe por experimentos en modelos animales que, en situación de hiperglucemia, existe una reprogramación de células intestinales con pérdida de la integridad de la barrera y de uniones célula-célula en el epitelio intestinal, que supondrían facilitar el paso del contenido bacteriano del intestino a la circulación.
En comparación con individuos sanos, los pacientes con DM2 tienen niveles sistémicos más altos de lipopolisacárido (LPS), producto de bacterias Gram negativas en la sangre, como resultado de una mayor permeabilidad intestinal y, por tanto, de la translocación bacteriana producida en esta región. El LPS estimula al sistema inmunitario, en concreto y especialmente a macrófagos en distintos tejidos, y así incrementa la inflamación sistémica. Este hecho promueve aún más el deterioro de la función de la insulina en los órganos periféricos y da como resultado la pérdida de la sensibilidad a dicha insulina.
LA RECIENTEMENTE DESCRITA COMO “INFLAMACIÓN METABÓLICA DE BAJO GRADO” O METAINFLAMACIÓN CONTRIBUYE AL DESARROLLO DE RESISTENCIA A LA INSULINA Y PROGRESIÓN DE LA DM2
Las inmunoglobulinas o anticuerpos son producidas por unas células especializadas del sistema inmunitario llamadas células B, que se encuentran en distintas localizaciones tisulares, incluido el intestino. Su función está alterada en DM2 y en obesidad. En esta situación, las células B se acumulan en altas cantidades dentro del tejido adiposo. Se ha observado que estas células producen citocinas inflamatorias en este tejido y promueven así la inflamación y resistencia a insulina. Cuando en modelo animal el tejido adiposo se depleciona de células B, se muestra la mejora de la respuesta inmunitaria inflamatoria y del metabolismo de la glucosa.
Adicionalmente al tejido adiposo, el hígado contribuye en la liberación a circulación de mediadores inflamatorios que contribuyen a la inflamación crónica. Los niveles de factores proinflamatorios producidos por el hígado, como la proteína C reactiva (CRP, del inglés C-Reactive Protein), son indicadores de riesgo cardiovascular en enfermedades metabólicas como DM2. Para este factor, tratamientos como canakinumab (bloqueante de IL-1b) se han observado que son beneficiosos pues reducen sus niveles e impacto inflamatorio en DM2.
¿Qué tratamientos pueden emplearse para el control de la microbiota intestinal y la inflamación?
Los tratamientos dirigidos a reducir la inflamación metabólica tienen efectos positivos en cuanto a tolerancia a la glucosa tanto en modelos animales como en humanos. Este hecho confirma la relación directa entre metainflamación y desarrollo de DM-2, y permite considerar dichos tratamientos como una buena opción en el manejo de la patología diabética.
La metformina empleada como fármaco reductor de niveles elevados de glucosa en sangre tiene un impacto directo sobre la microbiota intestinal. Es interesante el efecto observado por distintos autores, que en general identifican cambios en la composición de la microbiota tras la ingesta continuada de este fármaco por parte de pacientes con DM2. Además, se ha observado que este cambio en la microbiota se traduce en el incremento en bacterias productoras de SCFAs, como Akkermansia muciniphila, beneficiosas para el control de la respuesta inmunitaria inflamatoria. También, se ha observado, tanto en modelos animales como en pacientes sometidos a cirugía bariátrica, que el tratamiento con metformina mejora la respuesta de producción de anticuerpos IgA.
LA MICROBIOTA INTESTINAL HA DE ESTAR EN EQUILIBRIO CONSTANTE CON EL SISTEMA INMUNITARIO DADO QUE NUESTRA RELACIÓN CON ESTOS MICROORGANISMOS ES DE MUTUALISMO. SU PAPEL ES BÁSICO EN LA DIGESTIÓN Y PRODUCCIÓN DE METABOLITOS A PARTIR DE ALIMENTOS PROPIOS DE NUESTRA INGESTA DIARIA
La intervención en la dieta es clave para el control de la variedad de la composición de nuestra microbiota intestinal. Un incremento del consumo de alimentos ricos en fibra y la reducción de endulzantes artificiales se considera como un punto potencial para mejorar este aspecto. En ensayos recientes de intervención en la dieta con un incremento en consumo de productos integrales se observó un incremento de Bifidobacterium y Lactobacillus en la composición de microbiota intestinal, con aumento en los niveles fecales de butirato.
La línea de investigación en esta área para pacientes con DM2 contempla la regulación adicional de esta microbiota a través del uso de probióticos, adicionalmente a Akkermansia muciniphila y el potencial de esta bacteria, así como la consideración del trasplante de microbiota fecal. Este procedimiento implica el paso de microbiota de donante sano a paciente, con un restablecimiento de la variedad en poblaciones bacterianas intestinales y, por tanto, un nuevo mecanismo de control de la respuesta inflamatoria en DM2.
Aunque se está avanzando en el conocimiento de muchas de estas estrategias, queda mucho por investigar y estandarizar para que sean consideradas opciones de manejo de pacientes con enfermedades metabólicas.
Bibliografía
- Iatcu CO, Steen A, Covasa M. Gut Microbiota and Complications of Type-2 Diabetes. Nutrients. 2021 Dec 30;14(1):166. doi: 10.3390/nu14010166. PMID: 35011044; PMCID: PMC8747253.
- Scheithauer TPM, Rampanelli E, Nieuwdorp M, Vallance BA, Verchere CB, van Raalte DH, Herrema H. Gut Microbiota as a Trigger for Metabolic Inflammation in Obesity and Type 2 Diabetes. Front Immunol. 2020 Oct 16;11:571731. doi: 10.3389/fimmu.2020.571731. PMID: 33178196; PMCID: PMC7596417.
- Tilg H, Zmora N, Adolph TE, Elinav E. The intestinal microbiota fuelling metabolic inflammation. Nat Rev Immunol. 2020 Jan;20(1):40-54. doi: 10.1038/s41577-019-0198-4. Epub 2019 Aug 6. PMID: 31388093.
- Okubo H, Nakatsu Y, Kushiyama A, Yamamotoya T, Matsunaga Y, Inoue MK, Fujishiro M, Sakoda H, Ohno H, Yoneda M, Ono H, Asano T. Gut Microbiota as a Therapeutic Target for Metabolic Disorders. Curr Med Chem. 2018;25(9):984-1001. doi: 10.2174/0929867324666171009121702. PMID: 28990516.
- Sankararaman, S., Noriega, K., Velayuthan, S. et al. Gut Microbiome and Its Impact on Obesity and Obesity-Related Disorders. Curr Gastroenterol Rep 25, 31–44 (2023). doi: 10.1007/s11894-022-00859-0.
- Zhou W, Sailani MR, Contrepois K, Zhou Y, Ahadi S, Leopold SR, et al. Longitudinal multi-omics of host-microbe dynamics in prediabetes. Nature. 2019 May;569(7758):663-671. doi: 10.1038/s41586-019-1236-x. Epub 2019 May 29. PMID: 31142858; PMCID: PMC6666404.







