Introducción
Antes del descubrimiento de la insulina, en el verano de 1921, los pacientes con diabetes tipo 1 (DM-1) fallecían de forma irremediable en cetoacidosis. En Marzo de 1922, en la revista Canadian Journal of Medicine, se publicaron los primeros resultados del tratamiento con extractos de páncreas, administrados de forma subcutánea, de 7 pacientes con DM-11. Este tratamiento reducía la hiperglucemia, la glucosuria, y conseguía la desaparición de la cetonuria, con una mejora del estado general de los pacientes.1 En Diciembre de 1923, Frederick G. Banting y John JR. MacLeod recibieron el Premio Novel de Fisiología/Medicina por el descubrimiento de la insulina. La era del tratamiento de la diabetes mellitus con insulina había comenzado.
La insulina es una hormona esencial en el metabolismo de los hidratos de carbono, de las proteínas y de las grasas. La destrucción selectiva de las células β pancreáticas en la DM-1 provoca un déficit casi absoluto de insulina, que hace necesaria la administración de la misma. En la diabetes tipo 2 (DM-2), la secreción de insulina puede estar incluso aumentada en etapas iniciales, pero disminuye de forma progresiva con el tiempo. Se calcula que hasta un 25% de los pacientes con DM-2, a lo largo de su vida, necesitarán tratamiento con insulina para controlar la hiperglucemia.
En esta pequeña revisión se analizará el papel de la insulina en la homeostasis de la glucosa, los tipos de insulina utilizados en el tratamiento, y el desarrollo imparable de las insulinas en los últimos 100 años con finalidad última de reproducir la secreción fisiológica de insulina.
Insulina: una hormona necesaria para la homeostasis de la glucosa
La insulina es el tratamiento más eficaz para reducir la hiperglucemia. Sin embargo, reproducir la secreción endógena de insulina mediante inyecciones subcutáneas repetidas de insulina no es una tarea fácil. La secreción de insulina se halla regulada de forma exquisita. Es liberada tras la ingesta de los alimentos para evitar una hiperglucemia excesiva, aumentando la captación de glucosa por los tejidos periféricos, y se inhibe en caso de un descenso excesivo de la glucemia para evitar la hipoglucemia. La secreción de insulina en las comidas ocurre de forma rápida, es de gran magnitud y de corta duración (insulina prandial). Sin embargo, en el periodo interprandial y nocturno, existe una secreción basal de insulina, de mucha menor magnitud y persistente, que regula la producción hepática de glucosa y evita el catabolismo proteico, la lipolisis y la formación de cuerpos cetónicos.2
El tratamiento con insulina intenta reproducir la secreción fisiológica de insulina, induciendo picos de insulina tras la ingesta y mantenido niveles basales estables entre comidas y durante el periodo nocturno. Sin embargo, la administración exógena de insulina se realiza habitualmente en el tejido celular subcutáneo, y no directamente en la vena porta, que se halla conectada anatómicamente con el hígado2. Además, en pacientes con diabetes tipo 1, no existe un mecanismo de supresión automática en caso de glucemias bajas, lo cual aumenta el riesgo de hipoglucemia.2 En consecuencia, el exceso de insulina exógena en un momento determinado provocará hipoglucemia, y su defecto, hiperglucemia.
El objetivo prioritario del tratamiento de la diabetes es evitar la aparición/progresión de las complicaciones crónicas de la diabetes3,4. Sin embargo, conseguir el equilibrio entre un buen control glucémico y un riesgo mínimo de hipoglucemias es esencial y se asocia con una mejor calidad de vida de los pacientes con diabetes. De hecho, la hipoglucemia es considerada como el factor limitante más importante para alcanzar/mantener los objetivos glucémicos. Por ello, durante las últimas décadas, ha sido incesante la búsqueda de insulinas prandiales e insulinas basales con un perfil de acción más fisiológico y, por tanto, con menor riesgo de hipoglucemia.
El estudio DCCT (The Diabetes Control and Complications Trial) demostró que el tratamiento intensivo con insulina en pacientes con DM-1, con la finalidad de conseguir la casi-normoglucemia, reducía la aparición de las complicaciones microvasculares de la diabetes (retinopatía, nefropatía, neuropatía)3. Estos resultados confirmaron que el tratamiento intensivo, utilizando insulina prandial antes de cada comida e insulina basal, en forma de múltiples dosis de insulina (MDI) o infusión subcutánea continua de insulina (ISCI), es el tratamiento de elección en pacientes con DM-1. Sin embargo, el tratamiento intensivo se asoció con un incremento de 3 veces en el riesgo de hipoglucemias graves frente al tratamiento convencional3. Además, el tratamiento intensivo inducía aumento de peso, y con el tiempo, se objetivó un 30% más de riesgo de desarrollar sobrepeso frente al tratamiento convencional3. Estos efectos adversos se debieron en parte a la utilización de insulinas con un perfil de acción ‘poco fisiológico’, como la insulina regular administrada antes de las comidas y la insulina NPH (Neutral Protamine Hagedorn) como insulina basal.
Insulinas prandiales
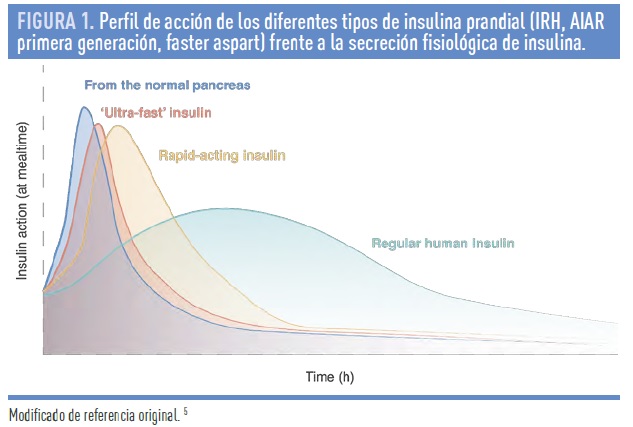
La insulina regular tiene la misma estructura de la insulina humana. Las moléculas de insulina se agrupan en solución en hexámeros. Sin embargo, cuando la insulina es inyectada en el tejido subcutáneo, los hexámeros deben disociarse en mónomeros antes de poder pasar al torrente circulatorio. Este proceso es el responsable del retraso en el inicio de la acción insulínica, lo que obligaba a administrar la insulina regular 20-30 minutos antes del inicio de la ingesta para poder controlar la hiperglucemia postprandial, de una forma más o menos satisfactoria.5
Para solucionar esta limitación se desarrollaron los análogos de insulina de acción rápida (AIAR). Los AIAR de primera generación (lispro, aspart, glulisina) presentan modificaciones en su estructura molecular que favorecen su disociación monomérica en solución, lo que contribuye a acelerar el proceso de absorción. De esta forma, tras la inyección, se consigue un pico más precoz, de mayor magnitud, y una menor duración de acción. Aunque los cambios estructurales en la molécula de insulina son diferentes, no existen diferencias notables entre los AIAR en el perfil farmacocinético y farmacodinámico.
En pacientes con DM-1, los AIAR demostraron, frente a la insulina regular, una reducción aunque discreta de la HbA1c y un menor riesgo de hipoglucemia, particularmente en el periodo nocturno.5 Además, la mayor rapidez en la absorción permite una administración un poco antes de las comidas y, con ello, una mayor flexibilidad en el tratamiento. Sin embargo, a pesar de todas estas ventajas, más recientemente el uso sistemático de los sistemas de monitorización continua de glucosa (MCG) ha demostrado que el control de glucemia postprandial con AIAR de primera generación dista mucho de ser ideal. Diversos estudios han demostrado que el momento óptimo de administración de estos AIAR es ~20 minutos antes del inicio de la ingesta.6
En consecuencia, se necesitan insulinas de absorción más rápida (ultra-rápidas), que permitan la inyección justo antes de la ingesta o incluso al terminar, sin comprometer el control glucémico. En los últimos años se han intentado diversas aproximaciones para acelerar la acción de la insulina como nuevas vías de administración (insulina inhalada), cambios en la formulación (con aditivos como ethylenediaminetetraacético [EDTA]/ácido cítrico, niacinamida, y otros) o modificaciones en el sitio de inyección (parches de calor local).
Faster aspart es la primera insulina prandial de una nueva generación de insulinas ultra-rápidas. Contiene 2 nuevos excipientes: niacinamida (vitamina B3) y L-arginina7. Estos excipientes aceleran la formación de monómeros y parecen aumentar localmente el flujo sanguíneo, resultando en una absorción subcutánea acelerada7. Los estudios farmacocinéticos y farmacodinámicos en DM-1 confirman que faster aspart es detectable en sangre a los 4 minutos, 2 veces antes que la insulina aspart, siendo los niveles de insulina circulante 2 veces superiores en los primeros 30 minutos, lo que resulta en un efecto hipoglucemiante hasta un 74% mayor que con aspart8. Los estudios en fase 3, en pacientes con DM-1 y DM-2, con múltiples dosis de insulina o con ISCI, demuestran una reducción comparable o mejor de la HbA1c, un mejor control de la glucemia postprandial, y menos riesgo de hipoglucemia tardía (en algunos estudios), antes de la siguiente ingesta. Por su mayor rapidez en la absorción, esta insulina puede administrarse inmediatamente antes de las comidas, e incluso hasta 20 minutos tras el inicio de la ingesta. En la figura 1 se incluye una representación esquemática del perfil de acción de las diferentes insulinas prandiales.
Insulinas basales
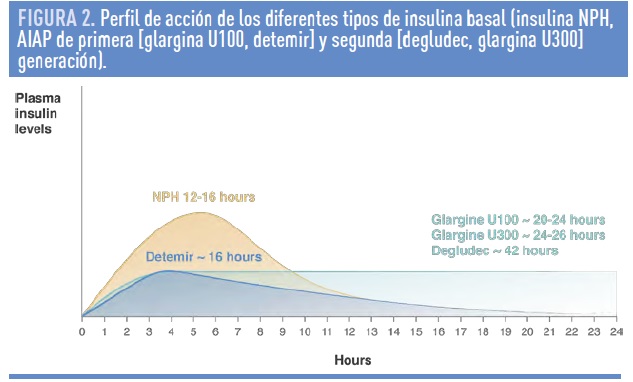
La insulina NPH es una insulina de acción intermedia, gracias a la adición de protamina a la insulina regular, con un pico de acción entre 4-10 horas y una duración de acción de 12-18 horas9. Esta insulina, de aspecto lechoso, presenta una gran variabilidad en la absorción, riesgo aumentado de hipoglucemia nocturna, y necesidad de al menos de 2 inyecciones al día para cubrir las necesidades basales diarias en muchos pacientes.9
La introducción de la primera generación de análogos de insulina de acción prolongada (AIAP, glargina U100, detemir) supuso un gran avance frente a la insulina NPH, con una reducción comparable de la HbA1c pero con una disminución significativa del riesgo de hipoglucemia, especialmente en el periodo nocturno10. La insulina glargina resulta de la sustitución de asparragina por glicina en la posición B21 y de la adición de 2 residuos de arginina en el extremo C-terminal de la cadena beta de la molécula de insulina11. Estos cambios producen una variación en el punto isoeléctrico de 5,4 en la insulina nativa a 6,8 en la insulina glargina, lo que reduce la solubilidad de la molécula a pH fisiológico. Cuando se administra por vía subcutánea, la solución de insulina glargina (pH= 4) forma unos microprecipitados, a partir de los que se libera insulina lentamente11. En la insulina detemir, el otro AIAP disponible, la unión de un ácido graso al aminoácido lisina en la posición B29 confiere una mayor estabilización a la forma hexamérica, lo que contribuye a retardar su absorción11. Además, esta cadena lateral facilita la unión a la albúmina plasmática enlenteciendo su disociación a la forma libre, que es la biológicamente activa11. Ambos AIAP se presentan en solución clara y no requieren agitación previa a la inyección, pero no se pueden mezclar con otras insulinas.
Las características farmacocinéticas y farmacodinámicas de los AIAP glargina y detemir resultan en un perfil de acción más predecible y un menor riesgo de hipoglucemias frente a la insulina NPH, especialmente menor frecuencia de hipoglucemias graves y nocturnas.11 La principal diferencia entre ambos AIAP es la duración de acción y la dosis. La insulina glargina puede administrarse una vez al día, en cualquier momento del día.12 La insulina detemir, por su menor duración de acción (figura 2), debe administrarse 2 veces al día en la mayoría de los pacientes con diabetes tipo 1 y DM-2.12 La menor potencia molar de la insulina detemir contribuye a que las dosis eficaces de ésta sean superiores a las de la insulina NPH o glargina.12
Sin embargo, a pesar de que estos AIAP de primera generación son todavía ampliamente utilizados, en muchos casos no cubren adecuadamente las necesidades de 24 h. con una sola inyección, deben de inyectarse en horarios fijos con poca flexibilidad, y su variabilidad en la absorción, aunque mejorada, se asocia con un riesgo de hipoglucemia mayor del deseable. Por este motivo, más recientemente, ha aparecido una nueva generación de AIAP (degludec, glargina U300).11 Glargina U300, al estar más compactada que glargina U100, tiene una disociación más lenta, mayor duración de acción y una menor variabilidad, lo que reduce aún más el riesgo de hipoglucemias nocturnas.11 Degludec, tras su inyección, forma multihexámeros que retardan su liberación. Además, la adición de un ácido graso en la cadena β aumenta su afinidad por la albúmina, lo que le confiera más estabilidad y prolonga aún más la duración de acción (hasta 42 horas)11. Degludec y glargina U300, aunque presentan algunas diferencias entre ellas, en comparación con los AIAP de primera generación (glargina U100, detemir), (1) cubren las necesidades diarias con una sola inyección y tienen una duración >24 horas, (2) tienen un perfil de acción más estable, con menor variabilidad, y (3) se asocian con un menor riesgo de hipoglucemia, especialmente en el periodo nocturno (figura 2)11.
Hacia una sustitución más fisiológica de la secreción de insulina
El tratamiento insulínico es imprescindible en la diabetes tipo 1 y puede ser necesario en la diabetes tipo 2. La combinación de insulina basal e insulina prandial intenta reproducir la secreción fisiológica de insulina. Un tratamiento sustitutivo óptimo es aquel que consigue reducir la HbA1c con el mínimo riesgo de hipoglucemia. Las hipoglucemias, especialmente las hipoglucemias nocturnas, tienen una importante repercusión en el control glucémico, en la calidad de vida y se asocian con importantes costes directos e indirectos, además de ser una barrera importante en la iniciación/intensificación del tratamiento insulínico.
La estrategia basal-bolus o MDI es la que mejor reproduce la secreción fisiológica de insulina, aunque requiere generalmente ≥ 3 inyecciones diarias. Como alternativa existe el tratamiento con ISCI, indicado en algunos pacientes con DM-1, que utiliza sólo AIAR para reproducir tanto el componente basal como prandial.13 En relación a la selección de la insulina prandial, se prefieren los AIAR de primera generación (lispro, aspart, glulisina) o faster aspart. La elección de uno u otro dependerá de las necesidades individuales de cada paciente, y de la exigencia en el control de la hiperglucemia postprandial. En cualquier caso, se aconseja el ajuste con ratios de insulina/hidratos de carbono y aplicación del Factor de Corrección13. Como insulina basal, se recomienda el uso de AIAP de primera (glargina U100, detemir) o segunda generación (degludec, glargina U300). La elección de una u otra dependerá de si el paciente presenta mayor o menor variabilidad glucémica, mayor o menor riesgo de hipoglucemias nocturnas, necesidad de cobertura de 24 horas, etc. La combinación del tratamiento intensivo, una educación terapéutica adecuada y del uso racional de la MCG es la clave del éxito.
Bibliografía:
- Banting FG, Best CH, Collip JB, Campbell WR, Fletcher AA. Pancreatic Extracts in the Treatment of Diabetes Mellitus. Can Med Assoc J 1922;12(3):141–6.
- Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet 2014;383(9911):69–82.
- The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977–86.
- UK Prospective Diabetes Study (UKPDS) Group. Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998;352:837–53.
- Home PD. The pharmacokinetics and pharmacodynamics of rapid-acting insulin analogues and their clinical consequences. Diabetes Obes Metab 2012;14:780–8.
- Cobry E, McFann K, Messer L, et al. Timing of meal insulin boluses to achieve optimal postprandial glycemic control in patients with type 1 diabetes. Diabetes Technol Ther 2010;12:173–7.
- Heise T, Hövelmann U, Brøndsted L, Adrian CL, Nosek L, Haahr H. Faster-acting insulin aspart: earlier onset of appearance and greater early pharmacokinetic and pharmacodynamic effects than insulin aspart. Diabetes Obes Metab 2015;17:682–8.
- Heise T, Pieber TR, Danne T, Erichsen L, Haahr H. A Pooled Analysis of Clinical Pharmacology Trials Investigating the Pharmacokinetic and Pharmacodynamic Characteristics of Fast-Acting Insulin Aspart in Adults with Type 1 Diabetes. Clin Pharmacokinet 2017;56:551–9.
- Heise T, Pieber TR. Towards peakless, reproducible and long-acting insulins. An assessment of the basal analogues based on isoglycaemic clamp studies. Diabetes Obes Metab 2007;9(5):648–59.
- Rossetti P, Ampudia-Blasco FJ, Ascaso JF. Old and new basal insulin formulations: understanding pharmacodynamics is still relevant in clinical practice. Diabetes Obes Metab 2014;16:695–706.
- Mathieu C, Gillard P, Benhalima K. Insulin analogues in type 1 diabetes mellitus: getting better all the time. Nat Rev Endocrinol 2017;13(7):385–99.
- Ampudia-Blasco FJ, Rosenstock J. Estrategias de insulinización en la diabetes mellitus tipo 2. Av Diabetol 2008;24:7–20.
- Ampudia-Blasco FJ. Tratamiento insulinico y bombas de infusión de insulina. In: Sociedad Española de Diabetes., editor. Manual del Residente de Endocrinología y Nutrición. 2018. https://manual.seen.es/article?id=55114e5e-fc48-4084-be86-2bcdac18103c. Última modificación: 22/01/2018 12:21